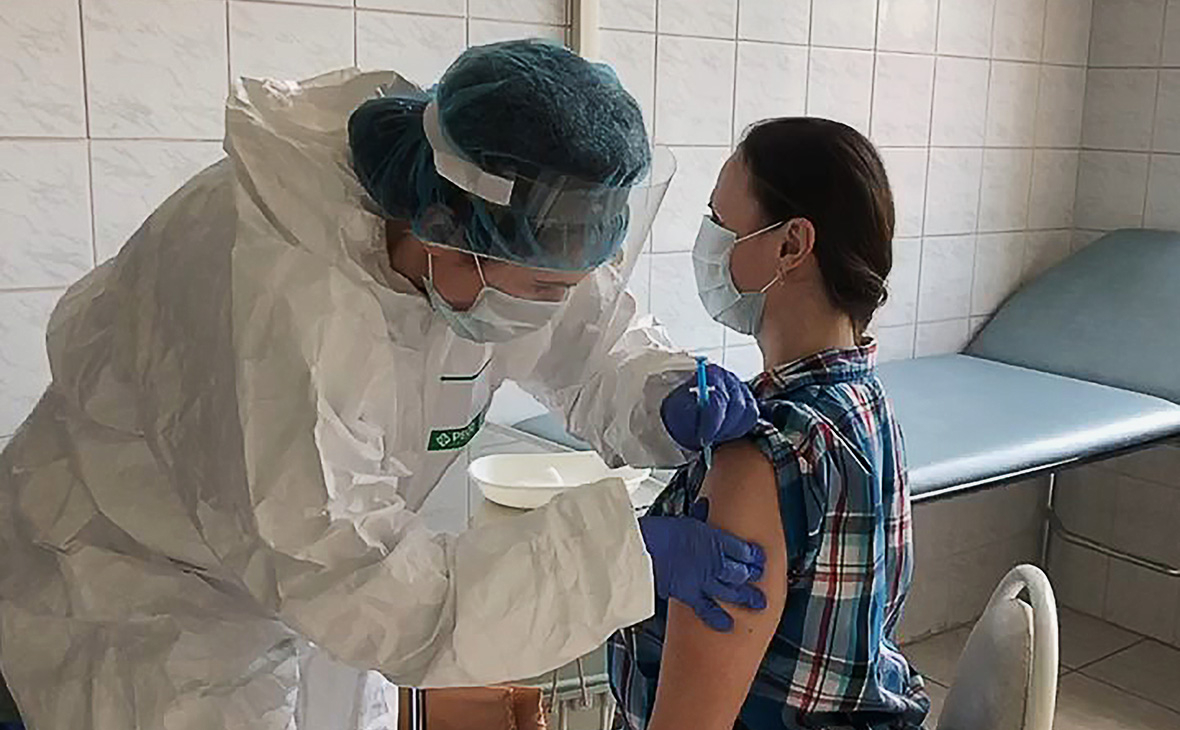
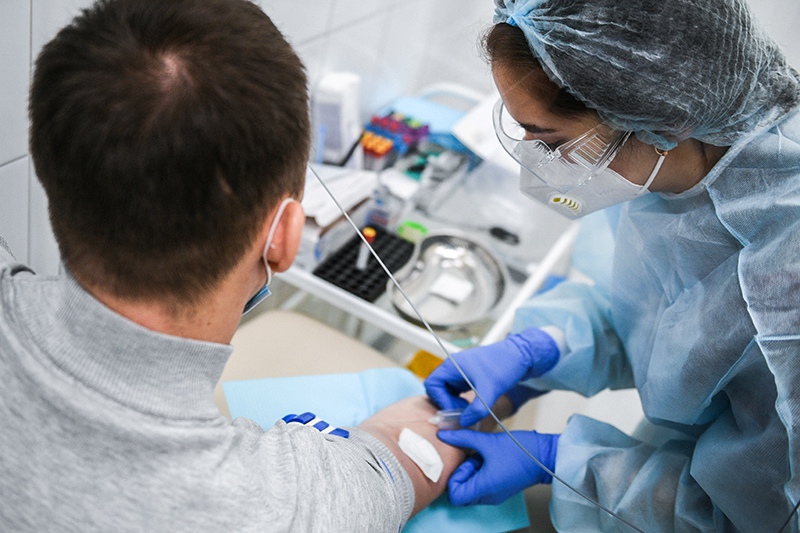
Клинические испытания
Прежде чем приступать к клиническим испытаниям, вакцина прошла в полном объеме все стадии доклинических испытаний по эффективности и безопасности, которые включали эксперименты на различных видах лабораторных животных, в том числе на 2-х видах приматов.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Все добровольцы хорошо перенесли испытания, не было зарегистрировано непредвиденных и серьезных нежелательных явлений, вакцина индуцировала формирование высокого как антительного, так и клеточного иммунного ответа. Ни один участник нынешнего клинического испытания не заразился коронавирусом после введения вакцины. Высокая эффективность вакцины была подтверждена высокоточными тестами на антитела в сыворотках крови добровольцев (в том числе проводили анализ на антитела, которые нейтрализуют коронавирус), а также способностью иммунных клеток добровольцев активироваться в ответ на S белок шипа коронавируса, что говорит о формировании и антительного и клеточного иммунного ответа в результате вакцинации.
Пострегистрационные клинические исследования с участием более 31 000 человек в России и Беларуси начались 25 августа 2020 года. Ряд стран, таких как ОАЭ, Индия и Венесуэла, начали местные клинические исследования вакцины «Спутник V». Вакцина получила регистрационное свидетельство Минздрава России 11 августа и в соответствии с правилами в связи с чрезвычайной ситуацией, принятыми во время пандемии COVID-19, может использоваться для вакцинации населения в России.
В ходе клинических испытаний фазы III вакцины «Спутник V» продемонстрировал высокую эффективность, иммуногенность и безопасность.
По данным исследований, эффективность вакцины «Спутник V» против COVID-19 составляет 91,6%. Расчет этого показателя производился на основе данных по 19 866 добровольцам, получившим и первую, и вторую инъекцию вакцины «Спутник V» или плацебо – на заключительном контрольном этапе зафиксировано 78 подтвержденных случаев COVID-19 Результаты исследования эффективности вакцины «Спутник V» прошли сравнительную международную оценку, полученные данные опубликованы в журнале .
«Спутник V» обеспечивает полную защиту от клинических случаев тяжелой степени COVID-19 «Спутник V» гарантирует устойчивый гуморальный (выработка антител, являющихся первой линией защиты) и клеточный (долгосрочная защита) иммунный ответ.
Результаты клинических испытаний фазы III подтвердили высокий уровень безопасности и иммуногенности вакцины «Спутник V», в том числе для пожилых людей.
- У более чем 98% добровольцев из группы вакцинирования сформировался гуморальный иммунный ответ и 100% клеточный иммунный ответ.
- Уровень вирус-нейтрализующих антител у добровольцев, вакцинированных «Спутник V», был в 1,3 — 1,5 раз выше, чем у пациентов, выздоровевших после COVID-19.
- Эффективность вакцины для лиц пожилого возраста составила 91,8% и статистически не отличалась от таковой для группы лиц возраста от 18 до 60 лет.
- Вакцина продемонстрировала отличные параметры безопасности. Большинство нежелательных явлений (94%) были легкими и включали гриппоподобные синдромы, реакции в месте инъекции, головную боль и астению.
- Независимым комитетом по мониторингу данных подтверждено, что никаких серьезных нежелательных явлений, связанных с вакцинацией, не наблюдалось.
- Не наблюдалось случаев ни сильной аллергии, ни анафилактического шока.
По результатам анализа 3,8 млн вакцинированных россиян эффективность вакцины «Спутник V» составила 97,6%.
Активное вещество вакцины Спутник V и способ его использования имеет патентную защиту на территории России, которая принадлежит Национальному исследовательскому центру эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи.
Особенности ковида и другие проблемы
Следующие ниже проблемы были предоставлены профессионалами здравоохранения в Италии, Великобритании и США и основаны на реальном опыте.
Заболевание не является «типичным» респираторным дистресс-синдромом взрослых (ОРДС).
Микроваскулярный тромбоз в малом круге кровообращения может привести к увеличению мертвого пространства. Ранний легочный фиброз после заболевания был зарегистрирован в Италии. Проблема может быть связано с кислородом или воспалением
Легочный тромбоз был связан с клиновидными инфарктами легких при визуализации без признаков тромбоза глубоких вен.
Как при НИВ, так и при МВ, положение пациента на животе может иметь важное значение и должно выполняться на ранней стадии. Эту процедуру нужно проводить чаще одного раза в день
Сохраняйте более низкий порог для внедрения меры, даже если обычным порогом является коэффициент PF, равный 130. На ранней стадии польза будет ограниченной, но по мере того, как болезнь переходит в ОРДС, положительные эффекты становятся длительными. Позиционирование на животе в MIV должно сопровождаться HNFO или NIV (предпочтительно в положении лежа), если насыщение не сохраняется. Порог интубации должен быть низким, если НИВЛ не работает более часа.
Многие центры с хорошим эффектом используют вдыхаемый оксид азота и простациклин. Тахифилаксия оксидом азота обычно наблюдается через 4-5 дней.
Поддерживайте эуволемию. Существует высокий риск острого повреждения почек при гиповолемии.
Экстубацию следует откладывать дольше, чем обычно, особенно если маркеры воспаления остаются высокими. Перед экстубацией всегда выполняйте проверку на герметичность.
Вакцина COVID
Число научных исследований по разработке вакцины против Sars-CoV-2 увеличивается. Во всем мире в разработке находится более 100 вакцин-кандидатов, из которых 8-10 находятся в стадии клинических исследований. Первыми завершили первые фазы исследования китайские ученые. Тем не менее несколько исследований продолжаются, особенно активно в США, Великобритании и России.
Научные исследования по разработке вакцины против Sars-CoV-2
Первое испытание на людях
На днях Великобритания полностью одобрила вакцину против Covid-19. Pfizer/BioNTech разработали фармацевтические компании Pfizer (США) и BioNTech (Германия). Это вакцина нового типа mRNA, содержащая фрагмент генетического кода вируса.
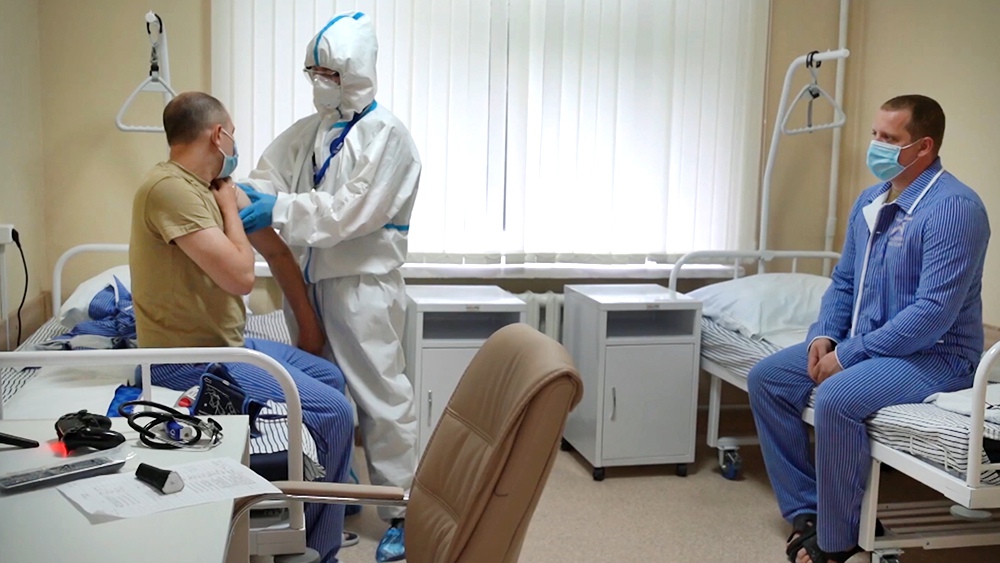
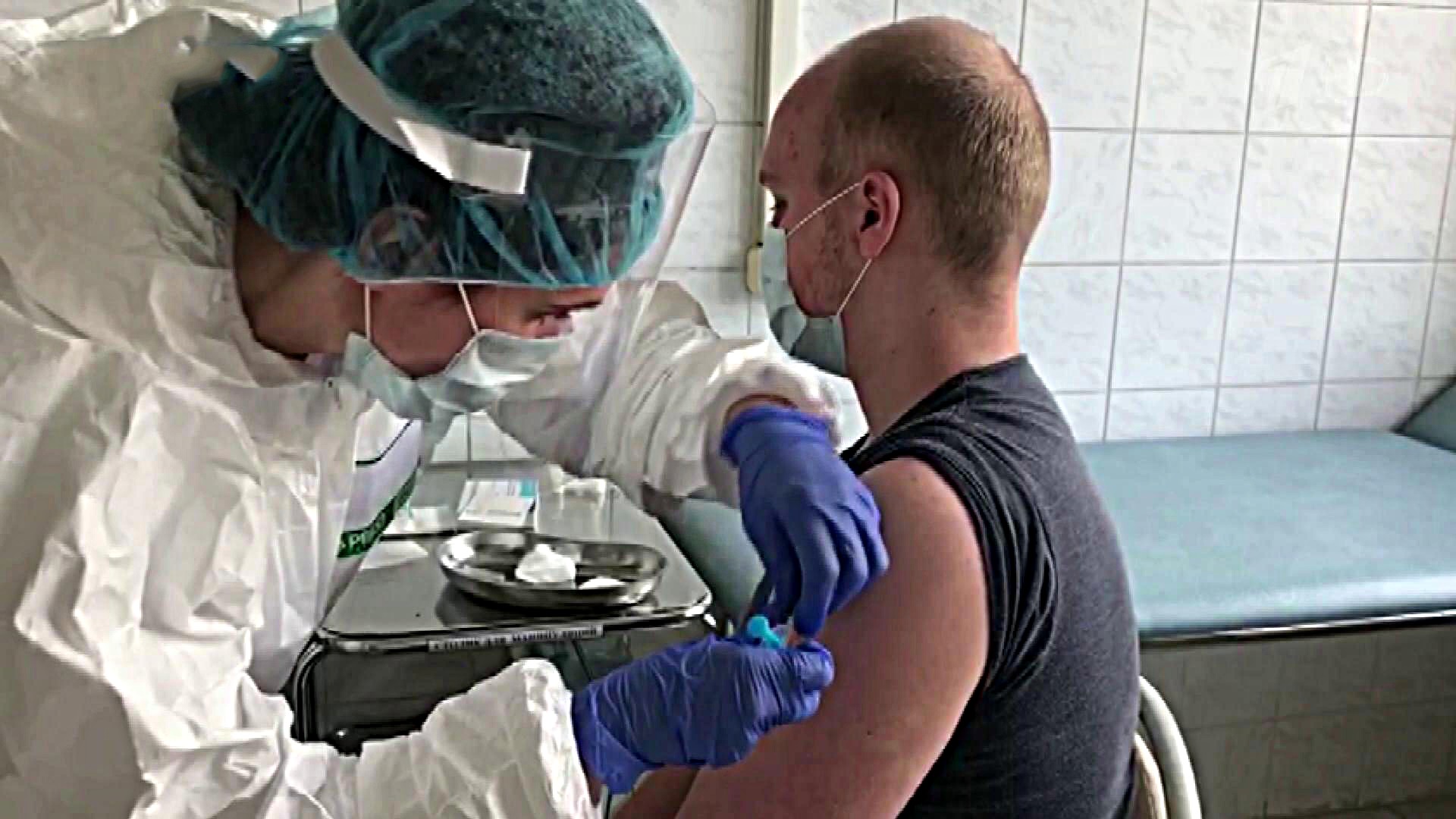
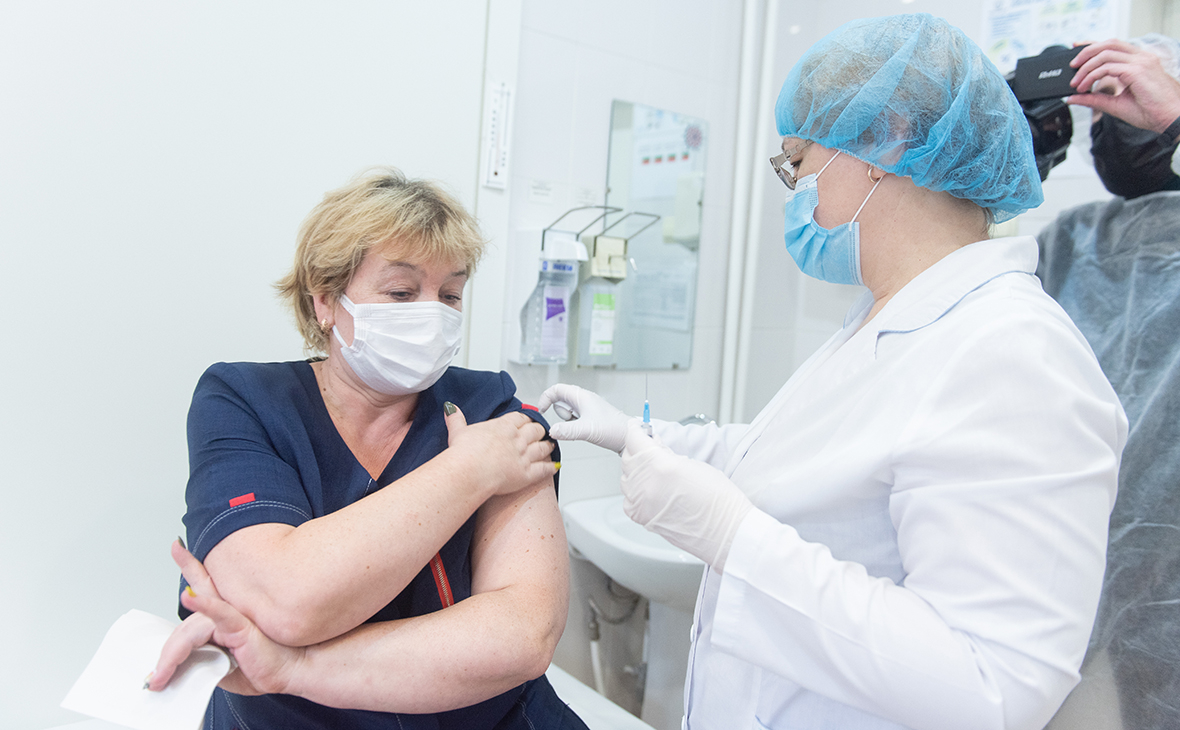
В России вакцина от НИЦ Н. Ф. Гамалеи, прошла пока только предрегистрационные клинические испытания, поэтому вводится добровольцам
Профилактические рекомендации по COVID-19
ВОЗ и другие организации выпустили следующие общие рекомендации:
- Избегайте тесного контакта с людьми с симптомами простуды.
- Регулярно мойте руки.
- Избегайте сельскохозяйственных или диких животных.
- Люди с кашлем, насморком и чиханием должны держаться на расстоянии, носить маску, прикрывать одноразовыми салфетками рот и нос.
- Усилить, в частности, в отделениях неотложной медицинской помощи применение строгих мер гигиены для профилактики и контроля инфекций.
- Лица с ослабленным иммунитетом должны избегать бывать в коллективе.
- Самая важная стратегия – часто мыть руки, используя портативное дезинфицирующее средство для рук, и избегать контакта с лицом и ртом после взаимодействия с возможно загрязненной средой.
Дезинфицирующее средство для рук
Сами по себе изоляция и отслеживание контактов представляют собой недостаточные меры для сдерживания распространения болезни. Тем не менее их эффективность увеличивается с дистанцированием. В связи с этим исследование моделирования с данными от более чем 40 000 участников в Великобритании продемонстрировало, что сочетание изоляции и отслеживания контактов с мерами физического дистанцирования может быть эффективным для сокращения числа случаев, когда потребуется самоизоляция, и контактов, которые необходимо будет отследить, в свою очередь, контролируя передачу болезни.
Медицинские работники, ухаживающие за инфицированными людьми, должны использовать меры предосторожности при контакте и воздушно-капельном контакте, включая СИЗ – маски N95 или FFP3, средства защиты глаз, халаты и перчатки для предотвращения передачи патогена
Дифференциальный диагноз
Симптомы ранних стадий заболевания неспецифичны. Дифференциальный диагноз должен включать возможность широкого спектра инфекционных и неинфекционных (например, васкулит, дерматомиозит) общих респираторных заболеваний.
Дифференциальный диагноз в первую очередь ставится в отношении следующих заболеваний:
- Аденовирус;
- Грипп;
- Метапневмовирус человека (HmPV);
- Парагрипп;
- Респираторно-синцитиальный вирус (RSV);
- Риновирус (простуда).
В случае подозреваемых случаев необходимо использовать быстрое обнаружение антигенов и другие исследования для оценки распространенных респираторных патогенов и неинфекционных состояний.
Текущие исследования
Китайское рандомизированное двойное слепое плацебо-контролируемое клиническое исследование фазы II было разработано для оценки иммуногенности и безопасности Ad5-CoV, который кодирует полноразмерный спайковый белок SARS-CoV-2. Предполагаемая дата завершения исследования – 31 января 2021 г. (NCT04341389).
В США исследование компании направлено на оценку безопасности, переносимости, иммуногенности и потенциальной эффективности до 4 различных РНК-кандидатов вакцины SARS-CoV-2 против COVID-19. Последовательность шипа включена в две вакцины-кандидата, а две другие включают RBD. Эта фаза 1/2, рандомизированное, плацебо-контролируемое, слепое исследование с поиском дозы, завершится в марте 2023 г. (NCT04368728).
Другое исследование фазы I было разработано для оценки безопасности, переносимости и иммунологического профиля вакцины, вводимой путем внутрикожной инъекции с последующей электропорацией, которая представляет собой метод, используемый для облегчения прохождения лекарств через клеточную мембрану с помощью специального устройства (NCT04336410).
В исследовании, проведенном Национальным институтом аллергии и инфекционных заболеваний (NIAID), участники делятся на три параллельные группы в зависимости от дозы инкапсулированной липидными наночастицами (LNP) вакцины на основе мРНК, которая кодирует спайковый белок SARS-CoV- 2 (мРНК-1273). Его вводят путем внутримышечной инъекции на 1-й и 29-й день, и пациенты будут находиться под наблюдением в течение 12 месяцев после второго введения. Дата завершения исследования назначена на 1 июня 2021 года (NCT04283461).
Противовирусный препарат Ремдесивир