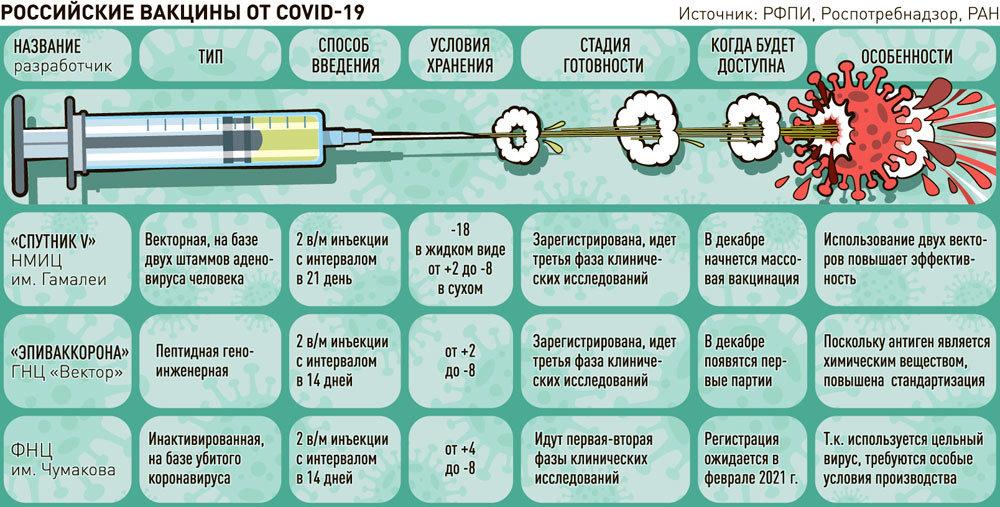
Какие испытания прошла вакцина от коронавируса?
Сразу после синтеза нового препарата, ученые провели доклиническое тестирование на хомячках и приматах. Проверяли токсичность, безопасность и эффективность новой вакцины. Никаких осложнений, побочных реакций у животных не возникло, поэтому ученые приступили к клиническим испытаниям на людях.
Первая фаза испытаний обычно проводится на небольшой группе здоровых добровольцев. Для тестирования российской вакцины «Спутник V» было привлечено 76 военных возрастом от 18 до 60 лет. Фаза была разделена на два этапа.
Первый этап длился 28 дней. Девятнадцати добровольцам поставили первую часть вакцины, основанной на ослабленном аденовирусе 26 типа, другим девятнадцати – вторую, с аденовирусом 5 типа. Так была проверена безопасность обоих компонентов вакцины. Результатом этапа стала хорошая переносимость препарата всеми добровольцами. Побочные эффекты были легкими или умеренными:
- боль в месте инъекции (58%);
- повышение температуры (50%);
- головная боль (42%);
- слабость (28)%;
- боль в мышцах и суставах (24%);
Опасных для жизни побочных эффектов обнаружено не было.
Во время второго этапа исследовался уже формирующийся после вакцинации иммунитет. Все добровольцы получили обе части вакцины с разницей в 21 день между ними. На 28 день после введения второй дозы, с помощью высокоточных тестов, у 100% добровольцев были обнаружены антитела к SARS-CoV-2. Более того, было доказано формирование другого – клеточного иммунитета. Обычно он сохраняется в «памяти» организма несколько лет.
Спустя три месяца после старта третьей фазы клинических испытаний в декабре 2020 г. российский Минздрав принял решение совместить последний этап исследований с массовой вакцинацией населения прививкой «Спутник V». Решение приняли оперативно, основываясь на предварительных результатах, опубликованных разработчиками вакцины в ноябре 2020 г.
В основе проведенных расчетов лежат случаи заболевания COVID-19 среди уже привитых добровольцев. Из общего числа участников испытаний, получивших обе положенные инъекции вакцины или плацебо (18 794), к концу третьей недели после второго укола вирус был диагностирован у 39 человек.
31 случай заражения был выявлен у тех, кто получил плацебо. В группе волонтеров, привитых настоящей вакциной, COVID-19 был диагностирован у восьмерых (группа получивших вакцину – в три раза больше группы плацебо). Сопоставление результатов по двум группам дает результат эффективности вакцины в 95%.
«Набранная группа участников исследований позволяет в полной мере исследовать профиль безопасности и профилактической эффективности вакцины на длительном промежутке времени», – пояснили в Минздраве.
Несмотря на то, что прививка «Спутник V» стала доступна всем желающим (за исключением группы с противопоказаниями), ученые продолжили наблюдение за добровольцами, принявшими участие в третьей фазе клинических испытаний. Второго февраля 2021г. разработчики вакцины представили результаты исследования в авторитетном медицинском издании The Lancet.
Клинические испытания
Прежде чем приступать к клиническим испытаниям, вакцина прошла в полном объеме все стадии доклинических испытаний по эффективности и безопасности, которые включали эксперименты на различных видах лабораторных животных, в том числе на 2-х видах приматов.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Все добровольцы хорошо перенесли испытания, не было зарегистрировано непредвиденных и серьезных нежелательных явлений, вакцина индуцировала формирование высокого как антительного, так и клеточного иммунного ответа. Ни один участник нынешнего клинического испытания не заразился коронавирусом после введения вакцины. Высокая эффективность вакцины была подтверждена высокоточными тестами на антитела в сыворотках крови добровольцев (в том числе проводили анализ на антитела, которые нейтрализуют коронавирус), а также способностью иммунных клеток добровольцев активироваться в ответ на S белок шипа коронавируса, что говорит о формировании и антительного и клеточного иммунного ответа в результате вакцинации.
Пострегистрационные клинические исследования с участием более 31 000 человек в России и Беларуси начались 25 августа 2020 года. Ряд стран, таких как ОАЭ, Индия и Венесуэла, начали местные клинические исследования вакцины «Спутник V». Вакцина получила регистрационное свидетельство Минздрава России 11 августа и в соответствии с правилами в связи с чрезвычайной ситуацией, принятыми во время пандемии COVID-19, может использоваться для вакцинации населения в России.
В ходе клинических испытаний фазы III вакцины «Спутник V» продемонстрировал высокую эффективность, иммуногенность и безопасность.
По данным исследований, эффективность вакцины «Спутник V» против COVID-19 составляет 91,6%. Расчет этого показателя производился на основе данных по 19 866 добровольцам, получившим и первую, и вторую инъекцию вакцины «Спутник V» или плацебо – на заключительном контрольном этапе зафиксировано 78 подтвержденных случаев COVID-19 Результаты исследования эффективности вакцины «Спутник V» прошли сравнительную международную оценку, полученные данные опубликованы в журнале .
«Спутник V» обеспечивает полную защиту от клинических случаев тяжелой степени COVID-19 «Спутник V» гарантирует устойчивый гуморальный (выработка антител, являющихся первой линией защиты) и клеточный (долгосрочная защита) иммунный ответ.
Результаты клинических испытаний фазы III подтвердили высокий уровень безопасности и иммуногенности вакцины «Спутник V», в том числе для пожилых людей.
- У более чем 98% добровольцев из группы вакцинирования сформировался гуморальный иммунный ответ и 100% клеточный иммунный ответ.
- Уровень вирус-нейтрализующих антител у добровольцев, вакцинированных «Спутник V», был в 1,3 — 1,5 раз выше, чем у пациентов, выздоровевших после COVID-19.
- Эффективность вакцины для лиц пожилого возраста составила 91,8% и статистически не отличалась от таковой для группы лиц возраста от 18 до 60 лет.
- Вакцина продемонстрировала отличные параметры безопасности. Большинство нежелательных явлений (94%) были легкими и включали гриппоподобные синдромы, реакции в месте инъекции, головную боль и астению.
- Независимым комитетом по мониторингу данных подтверждено, что никаких серьезных нежелательных явлений, связанных с вакцинацией, не наблюдалось.
- Не наблюдалось случаев ни сильной аллергии, ни анафилактического шока.
По результатам анализа 3,8 млн вакцинированных россиян эффективность вакцины «Спутник V» составила 97,6%.
Активное вещество вакцины Спутник V и способ его использования имеет патентную защиту на территории России, которая принадлежит Национальному исследовательскому центру эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи.
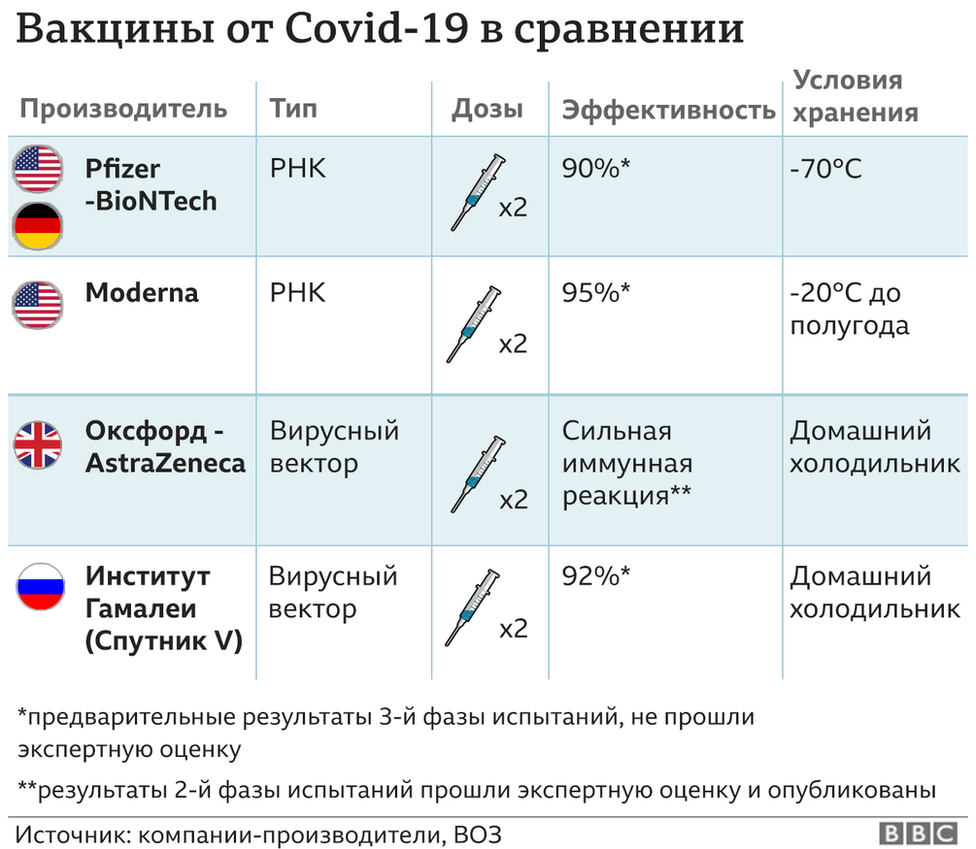
Насколько эффективны вакцины против COVID-19?
Все три вакцины против COVID-19 обеспечивают надежную защиту, предотвращая тяжелое течение заболевания, риск госпитализации и смерти от коронавируса.
-
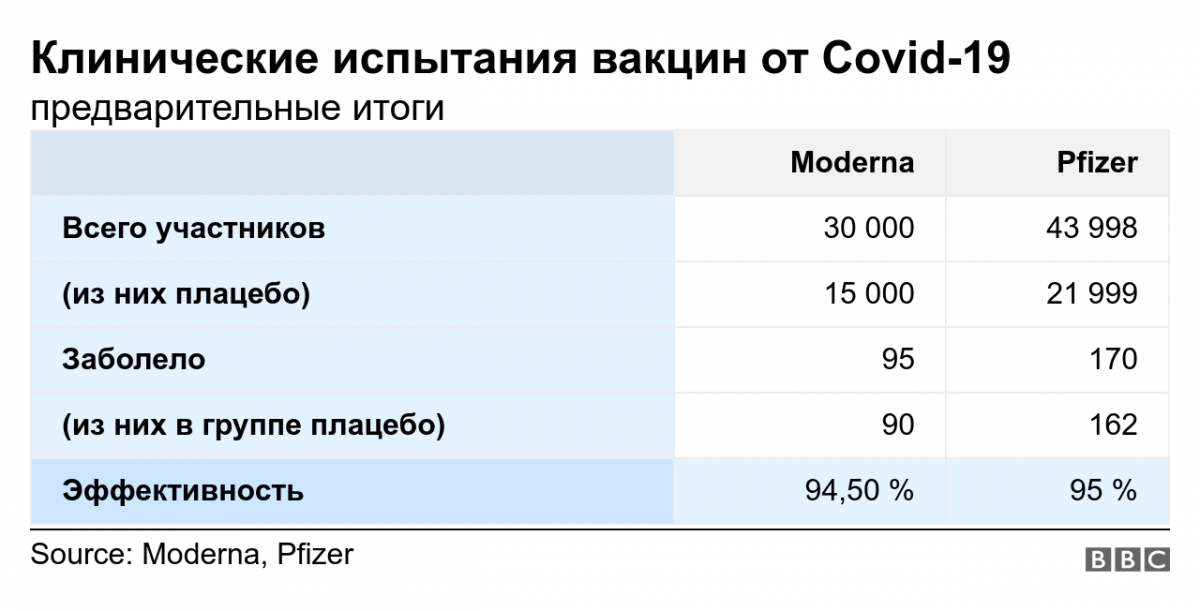
23 августа 2021 г. вакцина Pfizer-BioNTech (Comirnaty) против COVID-19 получила от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration (FDA)) полное разрешение на использование. Федеральное агентство приняло это решение после тщательного анализа обновленных данных клинических исследований вакцины Pfizer-BioNTech и технологических данных о вакцине, показавших 91%-ную эффективность вакцины в предотвращении развития инфекции, госпитализации и смерти от COVID-19. Ранее эту вакцину использовали в соответствии с разрешением на экстренное применение.
-
31 января 2022 г. вакцина Moderna (Spikevax) против COVID-19 получила от FDA полное разрешение на использование. Федеральное агентство приняло это решение после тщательного анализа данных клинических исследований и технологических данных, показавших 93%-ную эффективность вакцины в предотвращении COVID-19 и 98%-ную эффективность в предотвращении тяжелой формы болезни.
-
Вакцина Johnson & Johnson/Janssen (J & J) показывает 66%-ную эффективность.
Вакцины против COVID-19 были разработаны слишком быстро. Как мне убедиться в том, что вакцины против COVID-19 безопасны?
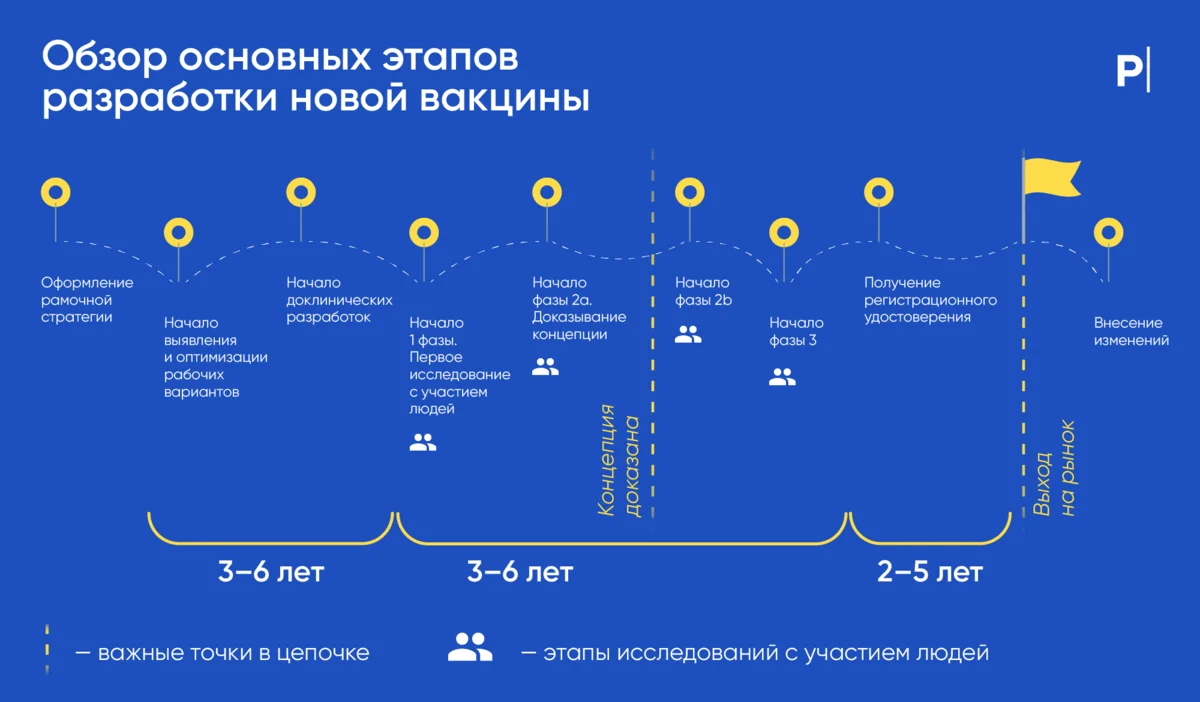
Быстрая разработка вакцин против COVID-19 объясняется тем, что ученые имели фору. Технология их изготовления уже существовала, и ее использование для разработки вакцины против нового вируса стало первостепенной задачей для мирового сообщества, что позволило направить миллиарды долларов на обеспечение безопасности при осуществлении срочных мер по спасению жизней. Регулирующие органы упростили некоторые этапы процесса получения разрешения, при том, что вакцины по-прежнему должны были соответствовать строгим стандартам FDA в отношении безопасности и эффективности. CDC продолжает тщательно отслеживать все нежелательные реакции.
Выявлено и исследовано несколько очень редких случаев серьезных побочных эффектов, но ученые пришли к выводу, что риск развития серьезных осложнений вследствие заболевания COVID-19 намного выше, чем риск проявления этих побочных эффектов. Ниже приведены доказательства этого тщательного и постоянного изучения.
-
В середине июля 2021 года в Центре контроля и профилактики заболеваний (CDC) заявили, что примерно у 100 из 13 миллионов американцев, получивших вакцину J & J, появился синдром Гийена-Барре. Синдром Гийена-Барре — это редкое неврологическое заболевание, при котором иммунная система организма атакует нервные клетки. Более подробную информацию можно прочесть здесь »
-
В конце июня 2021 года центр CDC сообщил, что у более чем 1200 американцев наблюдалось поражение сердечной мышцы, возможно связанное с вакцинами Pfizer-BioNTech и Moderna. Проблемы с сердцем встречались очень редко — на каждый миллион введенных вторых доз вакцины приходится 12,6 случаев поражений сердечной мышцы. Более подробную информацию можно прочесть здесь »
-
Специалисты CDC и FDA заявляют, что на конец ноября 2021 г. выявлено 54 случая диагностирования нарушения свертываемости крови, называемого тромбоцитопенией, которое возникло после введения вакцины J & J (среди 16,4 миллиона доз). 16 декабря специалисты CDC порекомендовали американцам вместо вакцины J & J получать вакцину Pfizer-BioNTech или Moderna. Более подробную информацию можно прочесть здесь »
Нужно учитывать, что иРНК — это не ДНК, ее невозможно скомбинировать с ДНК, чтобы изменить ваш генетический код.
Механизм действия вакцин на основе иРНК следующий: они используют крошечный кусочек генетического кода коронавируса, чтобы научить вашу иммунную систему вырабатывать белок, который запустит иммунную реакцию в случае заражения.
Информационная РНК хрупкая, она передает инструкции вашим клеткам для выработки антител против SARS-CoV-2. иРНК не попадает в ядро клетки — ту часть, где содержится ДНК.
Вакцины не вызывают рак. Они не подвергают вас воздействию вируса, вызывающего COVID-19. Вы не можете заразиться COVID-19 или какой-либо другой инфекцией от вакцины. Более подробную информацию о принципе работы вакцин на основе иРНК можно прочесть здесь »
Новавакс – что это такое?
NVX-CoV 2373 — это белковая вакцина, использующая новую технологию рекомбинации белка коронавируса S в клетках насекомых. Использование инновационных решений позволяет ускорить процесс производства – рекомбинантный белок Spike, полученный из клеток ночной бабочки, должен сделать организм человека способным вырабатывать специфические антитела сразу после вакцинации. Препарат NVX-CoV2373 также содержит стабилизатор PS80, наночастицы и адъювант matrix-M,т. е. вещество, усиливающее иммунный ответ после введения продукта.
Новая вакцина от COVID-19 прошла 3 этапа испытаний, но на момент написания статьи еще не имеет регистрационного удостоверения препарата в США и Европе. Европейское агентство по лекарственным средствам может выдать рекомендацию только после оценки соответствия продукта стандартам безопасности, качества и эффективности.
По заявлениям в прессе, новая вакцина от коронавируса соответствует препаратам мРНК Pfizer / BioNTech и Moderna. По сравнению с оригинальной версией коронавируса эффективность продукта остается на уровне 96%.
Результаты исследований, проведенных в ЮАР и Великобритании, говорят, что препарат эффективен и при британской и южноафриканской мутации вируса. Этот факт подтверждает заявление пф. микробиологии и иммунологии Джона Мура (Нью-Йорк), давшего интервью Reuters. Специалист считает, что вакцина действительно эффективна против британской мутации коронавируса, что означает высокую вероятность ее эффективности и в США.
Блок новостей, связанных с вакцинацией против COVID-19
Результаты последней третьей фазы клинических испытаний вакцины «Спутник V»
Третья фаза испытаний вакцины «Спутник V» длилась с 7 сентября по 24 ноября. В ней приняли участие 21 977 человек, из них 16 427 были привиты, а 5435 – получили плацебо (раствором, в который входят все ингредиенты «Спутник V», кроме самого аденовирусного вектора).
Согласно выводам ученых специфические антитела против коронавируса вырабатывались через 42 дня после первой прививки или через 21 день после второй у 95,8% добровольцев. Более того, в день первой инъекции и через 28 дней после второй у добровольцев уже определялся клеточный иммунитет.
Что касается побочных эффектов, они проявились у 7966 привитых, при этом у 94% из них были легкими и включали повышение температуры, неприятные ощущения в месте инъекции, головную боль и слабость. Лишь 0,3% привитых имели серьезные побочные эффекты, однако, независимая комиссия не доказала связи между ними и вакцинацией.
Эффективность вакцины при таких показателях составляет 91.6%.
«Спутник V» также исследовали на добровольцах старше 60 лет – всего 2144 человека. Эффективность вакцины в этой группе практически не отличается от общей и составляет 91.8%.
Таким образом, вакцина показала свою эффективность и безопасность как у людей от 18 до 60 лет, так и у пожилых добровольцев. При этом серьезных побочных эффектов, связанных с вакциной, обнаружено не было.
Новавакс – вакцина от COVID. Кто производит препарат?
Производитель новой вакцины от COVID-19 — американская биотехнологическая компания Novavax, подписавшая соглашения о сотрудничестве по всему миру. Производственные предприятия, расположены в Италии, Чехии и Польше.
Что касается истории компании в плане создания вакцин, то она не столь красива и успешна. На протяжении десятилетий Novavax не могла родить ни одной актуальной вакцины, которую бы одобрили. В числе неудач вакцины против ВИЧ, свиного гриппа, атипичной пневмонии, ближневосточного респираторного синдрома, Эболы и др. История повторялась из раза в раз: сначала многообещающие результаты и инвестиции, затем либо слабая эффективность, либо отсутствие необходимости из-за спада пандемии.
Дело дошло практически до разорения — к январю 2020 г. стоимость акций скатилась до $4, а оставшихся оборотных средств едва хватило бы на полгода. Неудачи были и с другими продуктами. Например, можно вспомнить разрекламированный гормональный крем для женщин, так и не увидевший свет.
После переговоров по новому препарату ситуация в корне изменилась. Авторитетное издание The Wall Street Journal сообщило, что Novavax близка к регистрации одной из самых эффективных вакцин от COVID-19. Появились инвесторы, акции взлетели в цене в 60 раз, капитализация предприятия составила $15,4 млрд, обогнав некоторые компании-миллиардеры.
Vivli запустит портал для обмена данными из проб COVID-19
Доступ к данным завершенных исследований коронавируса будет предоставлен всем квалифицированным исследователям.
Кембридж, штат Массачусетс — в качестве видимого признака лидерства в области обмена данными, Vivli, центр клинических исследований данных, взял на себя обязательство служить открытому научному сообществу через запуск портала COVID-19 для обмена данными завершенных интервенционных проб лечения. Все членские и пользовательские сборы будут отменены для совместного использования и доступа.
“Сегодня мы объявляем об этой инициативе, поскольку это так важно для всего сообщества обмена данными, чтобы собраться вместе и сделать все возможное, чтобы поделиться данными из этих завершенных клинических испытаний”, — сказала Ребекка Ли, исполнительный директор Vivli. «Прозрачный и открытый обмен данными — это лучший способ уважать решения, принятые участниками этих испытаний, и приблизить нас к безопасному и эффективному лечению и вакцинам.”. Соучредитель Vivli, профессор UCSF и ведущий автор научной статьи, опубликованной сегодня, которая выступает за более открытый обмен данными со стороны NIH, повторила эти опасения
Соучредитель Vivli, профессор UCSF и ведущий автор научной статьи, опубликованной сегодня, которая выступает за более открытый обмен данными со стороны NIH, повторила эти опасения.
«Vivli была на переднем крае обмена данными, и я рад видеть, что мы делаем все возможное, чтобы продвинуть знания о пандемии COVID-19”, — сказала она «Vivli была создана для того, чтобы сделать обмен данными практичным и простым в использовании. Испытания COVID-19 должны быть открыты для всех исследователей, чтобы ни один камень не остался непокрытым при рассмотрении и анализе данных.”
Новая статья, опубликованная в разделе «Политика форума науки» Vivli и ключевыми лидерами по прозрачности данных, выступает за дополнительные изменения и усовершенствования для укрепления нынешнего проекта политики совместного использования данных NIH. В этой статье авторы рекомендуют “ » конкретная, практическая и реализуемая политика NIH может помочь преобразовать академическую культуру и практику в рутинный обмен данными.”
Авторами статьи являются Ида сим, Майкл Стеббинс, Барбара Э. Биерер, Атул Дж.Батт, Джеффри Дразен, Виктор Дзау, Адриан Ф. Эрнандес, Харлан М. Крумхольц, Бернард Ло, Бернард Муньос, Эрик Перакслис, Фрэнк Рокхолд, Джозеф С. Росс, Шэрон Ф. Терри, Кит Р. Ямамото, Дебора А. зарин и Ребекка Ли.
О Компании Vivli
Vivli-это некоммерческая организация, работающая над улучшением здоровья человека с помощью идей и открытий, полученных путем обмена и анализа данных. Это дом для независимой глобальной платформы обмена данными и аналитики, которая обслуживает все элементы международного исследовательского сообщества. Платформа включает в себя хранилище данных, углубленную поисковую систему и облачную аналитику, а также гармонизирует управление, политику и процессы для облегчения обмена данными. Vivli выступает в качестве нейтрального посредника между поставщиком данных и пользователем данных и более широким сообществом обмена данными. Для получения дополнительной информации посетите сайт www.vivli.org .
Могу ли я каким-либо образом предупредить или уменьшить побочные эффекты от вакцины?
Крайне важно, чтобы вы не принимали эти безрецептурные препараты перед вакцинацией, поскольку есть опасения, что некоторые обезболивающие лекарства могут повлиять на иммунный ответ на вакцину. Также неясно, действительно ли заблаговременный прием лекарств помогает уменьшить симптомы после вакцинации
Вам следует дождаться вакцинации, а затем наблюдать за своим самочувствием. При возникновении побочных эффектов можно принять безрецептурные препараты, например Advil или Tylenol, чтобы снизить температуру, уменьшить озноб или облегчить головную боль или ломоту в теле.
Вакцина от COVID-19: побочные эффекты, почему они возникают и как их устранить
Как это рекомендуют делать за рубежом
Авторитетные зарубежные рекомендации не только несколько отличаются от российских, но и различаются между собой. Для начала рассмотрим некоторые документы, подготовленные неонкологическими организациями. CDC не указывают в качестве временных противопоказаний к вакцинации никакие виды лечения рака. Агентство признает, что у этой группы пациентов может не сформироваться достаточный иммунитет против SARS-CoV-2, поэтому лицам с умеренно и сильно ослабленным иммунитетом (включая онкологических пациентов) CDC рекомендует вводить дополнительные дозы вакцины при первичной вакцинации или бустерные дозы.
NIH к вопросам переноса или отсрочки вакцинации подходят более строго. В их руководстве по лечению COVID-19 перечислены следующие возможные причины для них:
- Если возможно, вакцинацию против COVID-19 лучше завершить хотя бы за 2 недели до начала курса химиотерапии.
- Гематоонкологическим пациентам, которые проходят интенсивную химиотерапию, вакцинацию лучше отложить до восстановления абсолютного числа нейтрофилов.
- Реципиентам гемопоэтических стволовых клеток и CAR-T вакцинацию следует проводить спустя 3 месяца после лечения.
NCCN тоже рекомендует прививать против COVID-19 пациентов, перенесших трансплантацию костного мозга или другую клеточную терапию, спустя 3 месяца после процедуры. Однако в примечаниях авторы рекомендаций указали, что это противопоказание не является абсолютным («может быть рассмотрено»).
Еще одно возможное временное противопоказание от NCCN – интенсивное лечение онкогематологических пациентов цитотоксическими химиотерапевтическими средствами. Вакцинацию рекомендуют проводить после восстановления абсолютного числа нейтрофилов. Авторы рекомендаций делают ремарку, что этот показатель сам по себе не оказывает значительного влияния на иммунный ответ организма на вакцинацию, но является суррогатным маркером состояния иммунной системы. Они добавляют, что при лечении солидных опухолей нейтропения сохраняется недолго, поэтому этим периодом можно пренебречь.
Между вакцинацией против COVID-19 и обширными операциями NCCN рекомендует делать промежуток в несколько дней.
ESMO указывает, что в группу риска тяжелого течения COVID-19 входят не только пациенты с активным опухолевым процессом, но и люди, которые болели раком в течение последних 5 лет. В организации считают, что безопасность и эффективность вакцин против COVID-19 у онкологических пациентов со сниженным на фоне цитотоксического лечения иммунитетом потенциально могут быть такими же, как и у людей, не болеющих раком. Авторы заявления ESMO отмечают, что полученных в исследованиях данных недостаточно, чтобы твердо судить об этом, поэтому они сделали предварительные выводы на основании имеющейся информации.
Пациентам, перенесшим аллогенную трансплантацию стволовых клеток, ESMO рекомендует проводить вакцинацию спустя 6 месяцев после процедуры. Других противопоказаний авторы документа не выделяют. Они указывают, что вакцинацию лучше провести до системной терапии, однако если она уже начата, то целесообразно привить пациента, не дожидаясь ее завершения.
Чем этот препарат отличается от других вакцин
Это субъединичная вакцина, содержащая единственный специфический для коронавируса компонент – шипиковый белок, созданный в лаборатории. Белковые элементы внедряются в наночастицы, аналогичные по строению настоящему вирусу. Комплекс дополняется адъювантами, усиливающими иммунный ответ организма.
Положительный момент — Novavax можно транспортировать и хранить при 2-8 °C, предыдущие вакцины, например, Pfizer и BioNTech, требовали очень низких температур
Это позволяет транспортировать и хранить вакцину в условиях холодильника, что очень важно для труднодоступных мест и слаборазвитых стран
Новавакс – эффективность и побочные эффекты
Генеральный директор американской компании подчеркнул, что вакцина NVX-CoV2373 в целом хорошо переносилась участниками III фазы клинических испытаний. Испытания проходили в Великобритании и в районах высокой передачи британских и южноафриканских вариантов. На веб-сайте Национального института общественного здравоохранения говорится, что в третьей фазе испытаний приняли участие почти 30000 добровольцев в возрасте 18-84 лет.
После вакцинации чаще всего наблюдались легкие и преходящие поствакционные реакции — головная и мышечная боль, усталость, боль в месте прокола.
Как новые варианты вируса влияют на вакцины против COVID-19?
Предполагается, что разрабатываемые сейчас или уже одобренные вакцины против COVID-19 обеспечивают по меньшей мере некоторую степень защиты от новых вариантов вируса,
поскольку стимулируют широкий иммунный ответ с участием различных антител и клеток. Поэтому изменения, или мутации, вируса не должны свести на нет эффективность вакцин. Если какие-то из этих вакцин окажутся менее эффективными против одного или нескольких
вариантов, их состав можно будет модифицировать, чтобы поставить заслон этим вариантам.
В настоящее время продолжаются сбор и анализ данных о новых вариантах вирусного возбудителя COVID-19. ВОЗ поддерживает тесный контакт с учеными, исследователями и руководителями органов здравоохранения, чтобы понять, как выявленные новые варианты меняют
поведение вируса, в частности выяснить, влияют ли они на эффективность вакцин. Актуальную информацию о воздействии вариантов вируса, вызывающего COVID-19, на эффективность различных вакцин можно найти в публикуемых ВОЗ новостях о вспышках болезней. Имеющиеся исходные данные по этому вопросу пока что носят предварительный характер и постоянно уточняются.
Пока происходит изучение данного вопроса, нам следует делать все возможное для того, чтобы остановить распространение вируса и тем самым избежать мутаций, которые могут уменьшить эффективность существующих вакцин. Кроме того, эволюция вируса может потребовать корректировки
производства вакцин и внесения изменений в программы вакцинации, например, разработки вакцин сразу против нескольких штаммов, добавления бустерных доз и других корректировок. Возможность отслеживания любых изменений эффективности вакцин следует также
предусматривать при подготовке и проведении клинических исследований, масштабы и состав участников которых должны обеспечивать четкую интерпретацию результатов. Для понимания действенности вакцин их эффективность должна также изучаться в процессе
применения.