Обзор
С 2005 года в нашей стране введено понятие — высокотехнологичная медицинская (ВМП). Это особый вид медицинских услуг, которые подразумевают использование новейших достижений медицинской науки, например, применение генной инженерии, клеточных технологий или роботизированной техники для диагностики и лечения сложных заболеваний. Наиболее востребована такая помощь при заболеваниях сердца и сосудов, в травматологии и ортопедии, при глазных болезнях, а также для лечения пороков развития у новорожденных деток. Всего под определение ВМП попадает около 1500 видов дорогостоящей медицинской помощи. Однако каждый гражданин РФ имеет право получить её бесплатно. Единственное условие для этого — наличие показаний.
К видам ВМП, например, относятся:
- Трансплантации почки, сердца, поджелудочной железы, тонкого кишечника, печени.
- Имплантация дорогостоящих слуховых аппаратов (кохлеарная имплантация).
- Хирургические операции при опухолях внутренних органов.
- Операции при стенокардии и инфаркте (коронарная ангиография, баллонная ангиопластика, стентирование сосудов и др.), в том числе в экстренном порядке, без ожидания в очереди.
- Некоторые виды дорогостоящей химиотерапии у больных с опухолями крови.
- Комплексное лечение тяжелых форм псориаза.
- Лечение обширных ожогов (более 30% поверхности тела).
Полный перечень видов ВМП можно найти в Постановление Правительства РФ от 19 декабря 2016 г. № 1403 «О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2018 и 2019 годов».
ВМП оказывают как в крупных многопрофильных больницах, имеющих соответствующих специалистов и оборудование, так и в узкопрофильных стационарах, которые занимаются исключительно предоставлением высокотехнологичных услуг (кардиохирургические центры, центры экстракорпорального оплодотворения и т. д.). Изначально в программу входили только федеральные медицинские клиники, которые получали финансирование из федерального бюджета. Сейчас перечень медицинских заведений, оказывающих ВМП значительно расширен: большая часть из них имеет региональный статус, кроме того, право на оказание ВМП получили частные клиники.
Изменился и порядок оплаты. Наиболее популярные виды ВМП выделили в отдельный перечень. Это, например: стентирование коронарных артерий, установка искусственного водителя ритма, эндопротезирование тазобедренного сустава, применение генно-инженерных лекарственных препаратов при ревматоидном артрите, комплексное хирургическое лечение глаукомы, . Медицинские услуги из этого перечня оплачиваются теперь непосредственно из региональных фондов обязательного медицинского страхования.
Клиники, оказывающие ВМП в рамках базовой программы ОМС есть во многих городах нашей страны, что повышает транспортную доступность этого вида помощи для регионов, а также ускоряет и упрощает процедуру госпитализации на лечение. Есть мнение, что теперь медицинскую помощь из этой группы можно будет получить только в том регионе, где вы получили свой полис ОМС. Однако это не верно. В законе прописаны механизмы финансирования в тех случаях, когда ВМП в рамках базовой программы ОМС оказывается за пределами региона.
Более сложные и менее распространенные виды ВМП не входят в базовую программу обязательного медицинского страхования. Это уникальные операции, которыми владеет ограниченное количество узкоспециализированных врачей, или лечение с помощью особо сложного и дорогостоящего оборудования, которым нецелесообразно укомплектовывать региональные больницы. ВМП из этой группы оплачивается теперь из федерального фонда ОМС и доступна, как правило, только в федеральных лечебных заведениях, основная часть которых сосредоточена в Москве, Санкт-Петербурге и других крупных городах.
Механизм финансирования, а также принадлежность к программе ОМС важны, главным образом, для руководителей и персонала медицинского учреждения, работающего в системе ВМП. Если раньше клиники получали деньги по ВМП в начале года и могли закупить заранее дорогостоящие расходные материалы и лекарственные препараты, согласно выданному госзаданию (количеству квот), то теперь «деньги следуют за пациентом», то есть расчет с клиникой происходит уже по факту оказанного лечения.
Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
Участники: 100 — 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Для участия в этой фазе КИ пациенты отбираются по гораздо большему количеству критериев, чем в первую фазу. Например, не просто «рак молочной железы», а «рак молочной железы, стадия T2N1M0, HER2-положительный подтип».
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто — плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом — с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.
Всем — одинаковые на вид, вкус и запах лекарства.
Вся эта «конспирология» нужна, чтобы исключить умышленное или неосознанное искажение данных эксперимента участниками или исследователями.
Так, в первой фазе, где нет таких жестких требований, бывают ошеломительные результаты. Это «грязная» статистика, в фазе II она очищается от лишнего и результаты становятся правдоподобными.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Положение о госпитализации больных в клиники ФГБУ «СПб НИИФ» Минздрава России
Порядок госпитализации за счет средств федерального бюджета
- плановая специализированная, в том числе высокотехнологичная, медицинская помощь пациентам, имеющим направление органа управления здравоохранением субъекта РФ,
- плановая специализированная, в том числе высокотехнологичная, медицинская помощь пациентам, имеющим направления Министерства здравоохранения РФ;
- плановая специализированная медицинская помощь пациентам с заболеваниями, соответствующими темам научно-исследовательских работ;
- амбулаторно-консультативная специализированная помощь больным с подозрением или заболеванием туберкулезом, направленным медицинской организацией, оказывающей фтизиатрическую помощь.
Порядок госпитализации за счет средств Территориального Фонда Обязательного Медицинского Страхования (ТФОМС)
Госпитализация за счет средств Территориального Фонда Обязательного Медицинского Страхования (далее — ТФОМС) осуществляется в соответствии с действующими нормативными актами, регламентирующими и инструктивными документами о правилах оказания медицинской помощи за счет средств ОМС на территории Санкт-Петербурга:
- экстренная специализированная, плановая высокотехнологичная медицинская помощь в стационарных условиях в соответствии с плановым заданием на 2021 год, утвержденным в установленном порядке;
- специализированная медицинская помощь в амбулаторных условиях в соответствии с плановым заданием, утвержденным в установленном порядке.
Порядок госпитализации за счет средств Федерального Фонда Обязательного Медицинского Страхования (ФФОМС)
- плановая специализированная (в том числе высокотехнологичная) медицинская помощь в соответствии с государственным заданием на оказание высокотехнологичной помощи в 2021 году и требованиями действующих нормативных актов, регулирующих оказание высокотехнологичной медицинской помощи Федеральными государственными бюджетными учреждениями, подведомственными М3 РФ;
- плановая специализированная медицинская помощь в соответствии с плановым заданием, утвержденным в установленном порядке.
Порядок госпитализации за счет внебюджетных средств (негосударственные источники финансирования)
Госпитализация за счет внебюджетных средств (негосударственные источники финансирования) в соответствии с действующими нормативными актами и Положением о предоставлении платных медицинских услуг, утвержденным приказом директора:
- плановая специализированная медицинская помощь пациентам, не имеющим документально подтвержденных оснований на безвозмездное получение медицинской помощи за счет средств государственных бюджетных и внебюджетных источников;
- специализированная медицинская помощь пациентам, госпитализированным в экстренном порядке, не имеющим документально подтвержденных оснований на безвозмездное получение медицинской помощи за счет средств государственных бюджетных и внебюджетных источников, после стабилизации состояния и при возможности перевода для дальнейшего лечения по месту жительства или выписки по решению врачебной комиссии гражданам РФ;
- обратившимся в институт самостоятельно, без направлений медицинских организаций;
- лицам, независимо от гражданской принадлежности, пожелавшим получить помощь на платной основе при условии информирования их об условиях получения безвозмездной медицинской помощи на территории РФ;
- дополнительные услуги сверх объема бесплатной медицинской помощи по стандарту;
- дополнительные исследования сверх стандарта лечения по профилю заболевания.
Фаза I. Проверка механизма действия
Участники: 20 — 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
За что придется платить?
Мнение, что получив талон на ВМП, вы избавляетесь от необходимости что-либо оплачивать, увы, ошибочно. Откуда могут возникнуть непредвиденные расходы? Чаще всего это происходит в случае, если вам предстоит лечиться в федеральной клинике не по месту жительства или в частном лечебном заведении.
Во-первых, в этом случае программа ОМС не покрывает дополнительного обследования на базе этой клиники. А оно может потребоваться. Во-вторых, больничная палата, питание и прочие услуги в клинике, непосредственно не являющиеся частью ВМП тоже могут оказаться платными. Наконец, отдельные этапы лечения и реабилитации, а также расходные материалы тоже могут оказаться за пределами государственного финансирования. Например, по программе ВМП могут предложить установку отечественного импланта, а более качественный, импортный, при желании, можно приобрести за свой счет. Платными являются некоторые предварительные манипуляции при лучевой терапии, поиск донора костного мозга и др.
Фаза III. Подтверждающие исследования
Количество участников: 300 — 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку — и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные. В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12–18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25–30% случаев от всех, что были на старте третьей фазы.
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
Грустные истории. Зачем нужны клинические испытания и почему без них — плохо
Клиническое исследование/испытание (далее — КИ) — научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Раньше семейный доктор знал истории всех своих пациентов наизусть, врач мог всю жизнь прожить в одном городке, найти и запомнить персональный подход к лечению каждого. Тем более, выбор снадобий был невелик: целебные травы, пиявки, ртуть да мышьяк. Ответственности во времена постулата «на все воля Божья» на врачах было поменьше.
Мышьяком с конца XVIII «восстанавливали» потенцию и «лечили» артрит…
… а ртуть, например, была слабительным и «от сифилиса».
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
В идеале, медик должен использовать только те методы профилактики, диагностики и лечения, которые имеют крайне низкую вероятность получения «случайных результатов», потому что полезность и эффективность их доказана многими корректно проведенными экспериментами.
Это и есть доказательная медицина — единственный адекватный на сегодня подход к такому серьезному делу, как здоровье людей.
И именно клинические исследования — основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.
В 1937 умерли 105 детей и один взрослый, принимавшие «эликсир» из антисептика сульфаниламида и… ядовитого диэтиленгликоля. Да, тот, что сегодня используется в антифризе. Тогда фармкомпания M. E. Massengill по незнанию использовала его как растворитель, вспомогательное вещество. Никаких исследований безопасности полученного «коктейля» для людей не проводилось. Когда спохватились и изъяли препарат из продажи, жертв уже было более сотни. В 1938 г. Конгресс США принял закон об обязательных исследованиях препаратов до их поступления в продажу. Контроль за этим возложили на FDA (англ. Food and Drug Administration) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996–97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Рынок Medtech
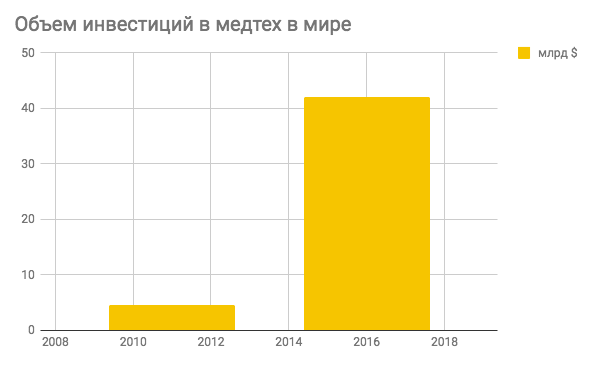
Согласно данным аналитического центра Deloitte Center for Health Solutions и ассоциации медицинских технологий The Advanced Medical Technology Association, инвестиции в производство медицинских изделий и оборудования в 1995 году в мире составляли около $668 миллионов.
Cтатистика также показывает, в 2016 году объем сделок в MedTech во всем мире составил $42 млрд. Для сравнения — в 2011 году инвестиции в MedTech были примерно равны $4,5 млрд.
Медицинские стартапы становятся одной из лидирующих отраслей венчурной индустрии в России. В 2016 году медтех-компании привлекли около $4 млрд инвестиций. Эксперты ожидают ежегодный прирост рынка на 13% до 2020 года.
Легко ли стать пациентом федеральной клиники по новым правилам? Минздрав опубликовал разъяснения
Минздрав опубликовал проект приказа, в котором разъясняется, как можно попасть на лечение в федеральную клинику, чтобы получить специализированную помощь, то есть ту, что не входит в программу ВМП.
Речь идет о специализированной медицинской помощи (СМП), которую пациенты получают в клиниках любого подчинения — городских, муниципальных, ведомственных и частных в рамках базовой программы ОМС. В правилах получения высокотехнологичной помощи изменений нет, она по-прежнему оказывается по так называемым квотам.
То есть, по сути, в федеральных клиниках пациенты смогут лечить те же заболевания, что и в местных, но с применением более современных методов. Министерство здравоохранения разработало порядок направления пациентов в федеральные клиники.
Когда пациента направят в федеральную клинику
Чтобы отправиться в федеральную клинику, например, в Москву или Петербург, за помощью пациент должен получить направление от лечащего врача клиники, в которой пациент проходит диагностику и лечение в рамках территориальной программы ОМС. Показания для получения направления на лечение в федеральную клинику: 1. нетипичное течение заболевания 2. отсутствия эффекта от проводимого лечения; 3. необходимость применения методов лечения, которые не используются в клиниках, подведомственных органам исполнительной власти субъекта РФ, в котором живет пациент; 4. высокого риска хирургического лечения в связи с осложненным течением основного заболевания или наличием сопутствующих; 5. необходимость выполнения повторных хирургических вмешательств из-за первых трех обстоятельств; 6. необходимость дополнительного обследования в диагностически сложных случаях и (или) в рамках комплексной предоперационной подготовки у пациентов с осложненными формами заболевания и (или) сопутствующими заболеваниями для последующего хирургического лечения; 7. необходимость повторной госпитализации по рекомендации федерального медучреждения; 8. в случаях, когда сроки госпитализации в клиниках, участвующих в реализации территориальной программы ОМС, превышают установленные сроки ожидания.
Что нужно сделать лечащему врачу, чтобы направить пациента на лечение в федеральную клинику
Если у пациента есть основания для получения специализированной медицинской помощи в федеральной клинике или он нуждается в повторной госпитализации по рекомендации федерального медучреждения, врач должен подготовить и направить документы в федеральную клинику через единую государственную информационную систему в сфере здравоохранения (ЕГИСЗ): 1. Выписку из медицинской документации, которая должна содержать диагноз заболевания (состояния), код диагноза по МКБ-10, сведения о состоянии здоровья, проведенных диагностике и лечении, рекомендации о необходимости специализированной медицинской помощи с указанием формы ее оказания (неотложная, плановая) в форме электронного документа. Врач должен также получить согласие на обработку персональных данных у пациента и (или) его законного представителя. 2. Направление на госпитализацию в форме электронного документа, с персональными данными пациента, сведениями о страховой организации, диагнозом, результатами лабораторных, инструментальных и других исследований, подтверждающих диагноз, а также с указанием медицинских показаний для специализированной медицинской помощи и ее профиля. Врач должен указать свои ФИО, должность врача, контактный телефон и электронный адрес.
Что делает федеральная клиника, чтобы принять пациента на лечение Собирает врачебную комиссию, которая в течение трех дней принимает решение о наличии (отсутствии) медицинских показаний для госпитализации пациента и оформляет протокол, в который вносятся все те сведения, что уже обозначил врач в своем направлении и выводы комиссии: госпитализировать или отказать в госпитализации. Третий вариант: комиссия делает вывод, что пациенту требуется высокотехнологичная помощь и направляет для ее получения в клинику. О принятом решении она сообщает пациенту в течение двух рабочих дней.
Как происходит исследование
К нам в атмосфере полной секретности привозят само вещество и толстую папку на 1 200 листов, где прописан дизайн и протокол исследования. Там указана каждая мелочь: как, в какое время и в каких дозах мы должны вводить препарат, как часто и в каком количестве брать кровь на анализ, какие анализы проводить, как часто делать МРТ и КТ. Сколько раз в день и в какой форме отправлять «шифровки в центр» — отчеты компании-организатору КИ.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т. п. Все это отражено в особом документе -информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались — для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Конечно, всех подряд взять в исследование не получится. Требования даются «сверху», и это очень узкий набор параметров: сколько должно быть лет участникам, какой точный диагноз, были/не было операций, уровень креатинина и железа в крови — до знака после запятой.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет — мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике — совсем не то, что в большом НИИ, но обычно 3–4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение — бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике — если это не запрещено дизайном КИ и пациент чувствует себя хорошо — он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами — расширенной возможностью применения новых препаратов — будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Материал подготовлен кандидатом медицинских наук, врачом-онкологом, заместителем главного врача по лечебной работе международной клиники Медика24 Сергеевым Петром Сергеевичем по материалам открытых источников.
Особенности национальных исследований: дополнительный этап КИ в России
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний — 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2–3 года замедляет пациентам доступ к новым лекарствам.
Международная клиника Медика24 участвует в исследованиях фазы III.
Так мы вносим вклад в ускорение процесса регистрации препаратов. Чем быстрее у фармацевтических компаний окажутся данные по необходимому количеству пациентов, тем быстрее лекарство «примут на вооружение». Сначала во всем мире, затем и у нас. В итоге мы влияем на то, чтобы его смогли получать все — не только в частных клиниках, но и в любом государственном онкодиспансере, по ОМС.
К тому же, для наших пациентов участие в клинических исследованиях III фазы — это возможность получить уже достаточно проверенное и безопасное новое лечение- без нескольких лет ожидания, пока оно официально «доберется» до России.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер — для пациентов. Чтобы запуститься в первый раз — пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.
Для разных препаратов — разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.