Профилактическая эффективность
В большинстве недавних исследований в качестве удобной и достоверно нелетальной животной модели профилактической эффективности вакцин против COVID-19 используется золотистый (сирийский) хомячок. У сирийских хомячков инфекция SARS-CoV-2 вызывает значительные патологические изменения в легких и, таким образом, поддерживает развитие стабильного постинфекционного гуморального иммунного ответа в экспериментах с пассивным переносом . Более того, наблюдаемые иммуногистохимические изменения и характер потери массы тела у хомячков сходны с легкой формой инфекции SARS-CoV-2 у человека . В ряде работ продемонстрирована пригодность сирийского хомячка в качестве модели для изучения профилактической эффективности НАт и вакцин против SARS-CoV-2 , хотя симптомы пневмонии у животного развиваются быстро и протекают тяжело.
Сирийский хомячок в качестве модельного объекта был использован для оценки профилактической эффективности нескольких инактивированных вакцин , в том числе одобренных для клинического применения . К основным параметрам оценки относят вес животного и присутствие вируса и/или вирусной РНК в мазках из носа, легких и других органов в разные сроки после инфицирования.
В исследовании авторов животные из группы контроля теряли вес до пятого — седьмого дня с момента заражения, тогда как вакцинированные набирали вес с начиная с третьего дня после заражения, что соотносится с данными о BBV152 . Однако потеря веса у контрольных животных в экспериментах авторов была более выраженной — 15 % против 2–10 % в исследовании BBV152. Скорость выведения вирусной РНК из верхних дыхательных путей также была сходной: начиная с седьмого дня после инфицирования в большинстве мазков из носа вирусная РНК не содержалась. Уровень вирусной РНК в легких контрольных животных был одинаковым в обоих исследованиях; по данным авторов, в органах всех контрольных животных содержалась вирусная РНК на четвертые, седьмые и 14-е сутки. Ткани легких вакцинированных животных в основном не содержали вируса: только у одного из пяти хомячков на четвертый и седьмой дни можно было выявить РНК вируса в легких; однако к 14-му дню ткань легких очищалась от вируса. Вирусная РНК была обнаружена в иных тканях (помимо легочной) у животных контрольной группы только на третий день после заражения. Аналогичные результаты были получены для вакцинного препарата BBV152 . Таким образом, представленные результаты демонстрируют профилактическую эффективность вакцины «КовиВак» на модели сирийского хомячка.
Таким образом, для вакцины «КовиВак» не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности или тератогенного влияния в антенатальном и постнатальном периодах развития, а также признаков гиперчувствительности у исследованных видов животных. Вакцина способствовала формированию стабильного и устойчивого гуморального иммунного ответа — как в виде специфических IgG к SARS-CoV-2, так и НАт у грызунов и обезьян. Значительного снижения титров НАт в течение одного года не наблюдалось. «КовиВак» продемонстрировала профилактический эффект по отношению к инфекции SARS-CoV-2 у сирийских хомячков. Эти данные стимулируют дальнейшее изучение вакцины «КовиВак» в клинических испытаниях.
Производство и описание вакцины
Ранее был представлен процесс выделения и генетического описания вакцинного штамма AYDAR-1 . Вирус удалось профильтровать на третьем пассаже и дополнительно очистить путем разбавления. Были созданы первичные, основные и рабочие посевные серии штамма (а именно пассажи под номерами 7, 8 и 9), которые были охарактеризованы в соответствии с национальными руководствами по производству вакцин.
Рисунок 1 | Процесс производства вакцины «КовиВак» и установление ее подлинности
A — Основная последовательность процесса производства вакцины; B — Трансмиссионная электронная микроскопия (ТЭМ) с негативным контрастированием концентрата инактивированной вакцины после хроматографической очистки; выделенная частица (внизу справа); C — Электрофорез (SDS-PAGE) вакцинного препарата (очищенный инактивированный вирусный препарат после хроматографии), окрашенный кумасси синим; D — Вестерн-блоттинг вирусного препарата перед инактивацией и вакцинный препарат (очищенный инактивированный вирусный препарат после хроматографии), окрашенный сывороткой человека-реконвалесцента после COVID-19; E — Вестерн-блоттинг препарата вируса перед инактивацией и приготовлением вакцины (очищенный препарат инактивированного вируса после хроматографии), окрашенный анти-S-белковой сывороткой кролика; F — культура клеток Vero, инфицированных SARS-CoV-2 и окрашенных сывороткой мыши, иммунизированной вакциной «КовиВак» (зеленое окрашивание на микрофотографии) и Hoechst 33342 (синее окрашивание на микрофотографии); G — клетки Vero, инфицированные SARS-CoV-2 и окрашенные сывороткой человека-реконвалесцента после COVID-19 (зеленое окрашивание) и Hoechst 33342 (синее окрашивание).
Благодаря трансмиссионной электронной микроскопии (ТЭМ) (рис. 1B) с негативным контрастированием концентратов были обнаружены плеоморфные сферические вирусные частицы диаметром около 120 нм, покрытые шиповидными структурами длиной 16–20 нм.
Методом ТЭМ (рис. 1B) были подтверждены гомогенность и чистота вакцинного препарата и выявлены вирионы с шипиковыми белками, соотносящиеся по форме и размеру с таковыми, выявляемыми в других исследованиях .
В ходе электрофореза SDS-PAGE и вестерн-блоттинга (ВБ) концентратов вакцин перед инактивацией и после хроматографии, окрашенных сыворотками реконвалесцентов после COVID-19 (рис. 1 C и D), были выявлены два основных белка в концентратах: N и S, которые должны содержаться и в препарате вириона. С помощью окрашивания сывороткой анти-S-белка (рис. 1E) были обнаружены две формы S-белка в вирусных препаратах до и после инактивации: S1 и полноразмерный S-белок. Это свидетельствует о том, что в вакцинном препарате присутствует антиген-мишень для индукции синтеза НАт.
Специфичность реактивности антител подтверждается отсутствием свечения (флуоресценции) в неинфицированных клетках культуры Vero.
Риск повторного заражения
Новость о том, что в Китае пошла вторая волна заражения коронавирусом у тех, то им уже переболел, снова взбудоражила мир. По последним данным в Ухане, где и была начальная вспышка, уже около 200 «новых» случаев заболевания, которые диагностированы у ранее переболевших людей. При этом врачей подобный вариант развития событий не удивляет, ведь переболеть ОРВИ дважды за сезон, а то и подряд — это не редкость. Почему так происходит?
Одна из них — ослабленный иммунитет, который неспособен противостоять инфекциям извне. В этом случае защитные силы организма попросту не справляются с поставленной перед ними задачей и не могут дать бой инфекции.
Вторая причина — недолеченность. Нередки ситуации, когда человек при первых же улучшениях перестает принимать лекарства в прописанных количествах. Ему кажется, что всё — болезненные ощущения снизились, а значит, можно и сбавить темпы, чтобы, например, не травить себя таблетками. В результате оказывается, что он не до конца победил вирус, и тот под действием благоприятных для себя причин вдруг снова выстреливает.
Например, антибиотики бесполезны в борьбе с вирусом. И если их все же пить, на сам возбудитель они не подействуют, но зато будут добивать иммунную систему. В идеальном раскладе к врачу надо обращаться как можно быстрее, в самом начале заболевания. Это требуется для получения грамотной схемы лечения, подбора лекарств и прочих деталей.
Специфический иммунитет
В этом случае иммунная реакция направлена против определенного фактора — типа вируса или бактерии. На его создание уходит несколько дней. Однако, как только он развился, он очень эффективен, поэтому нас интересует именно этот вариант.
Он включает:
- Клеточный иммунитет. Этот тип иммунитета зависит от Т-лимфоцитов и заключается в прямой атаке и уничтожении этими лимфоцитами вирусов и бактерий. Болезнетворные микроорганизмы попадая в организм поглощаются макрофагами. Затем выделяется ряд веществ — антигенов, т.е. фрагментов уничтоженного патогена, к Т-лимфоцитам. Это стимулирует Т-клетки при обнаружении антигена на поверхности микроорганизма немедленно его устранять.
- Гуморальный иммунитет. Зависит от антител, вырабатываемых В-лимфоцитами. Они обладают способностью связываться с вирусами и бактериями и таким образом устранять их. Как и в клеточном ответе, В-лимфоциты активируются первыми, трансформируются в плазматические клетки и начинают вырабатывать первичные антитела, т.е. те, которые связываются непосредственно с антигенами вируса/бактерий. Это антитела типа M (IgM) в начале, позже к ним присоединяются антитела типа G (IgG).
Специфический иммунитет – также можно разделить по длительности действия на кратковременный (пассивный) и длительного действия (активный) и естественный и искусственный:
- естественный пассивный иммунитет – антитела в грудном молоке;
- искусственный пассивный иммунитет – введение сыворотки с антителами;
- специфический активный естественный иммунитет – после болезни;
- специфический активный искусственный иммунитет – вакцинация.
Специфический активный естественный иммунитет, полученный после болезни и специфический активный искусственный иммунитет после прививки будут бороться с вирусом, но чтобы добиться иммунитета, организм проходит разный путь.
Чем отличаются и как работают вакцины
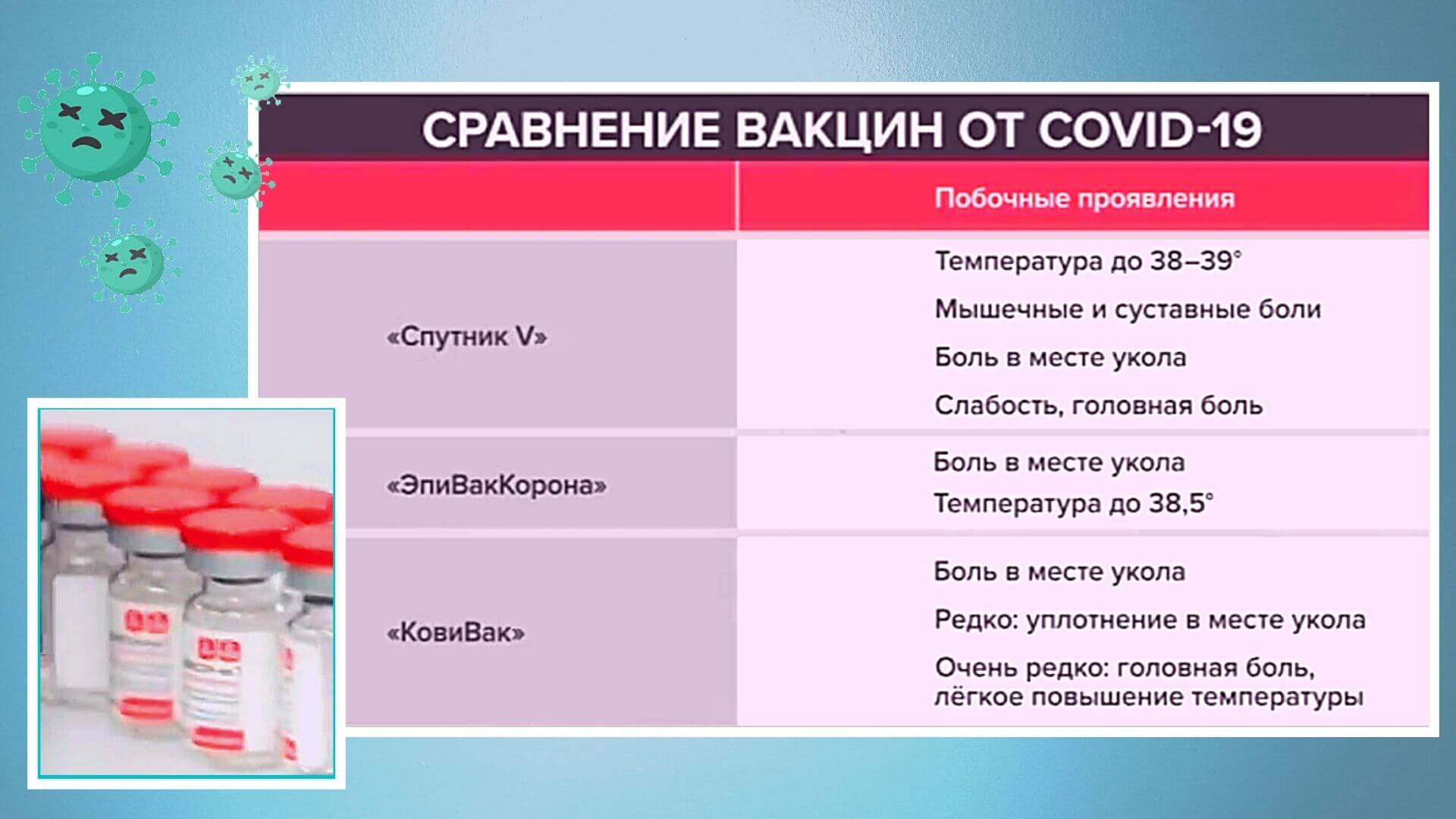
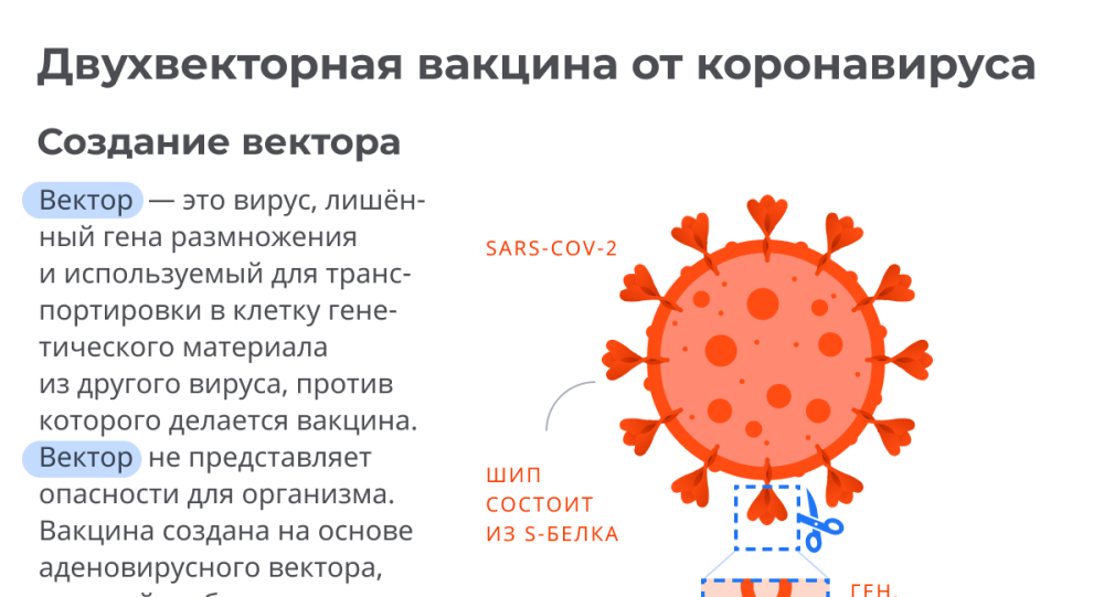
«Спутник V» — комбинированная векторная вакцина. Она состоит из двух доз, в составе которых находятся неспособные к размножению аденовирусы-векторы, которые доставляют в организм ген коронавирусного S-белка. После прививки клетки организма начинают производить этот белок, а иммунная система реагирует на него. Антитела к этому белку (точнее, к его рецептор-связывающему домену) считаются нейтрализующими, то есть препятствующими заражению.
«Эпиваккорона» — пептидная вакцина. В отличие от «Спутника V» она не несет в себе биологического агента и состоит из искусственно синтезированных коротких фрагментов вирусных белков (пептидов), через которые иммунная система обучается и в дальнейшем распознает и нейтрализует вирус.
«Ковивак» — это так называемая цельновирионная вакцина. В ее основе используется коронавирус SARS-CoV-2, который специально обработан так, что лишился своих инфекционных свойств, но при этом сохраняет способность вызывать иммунную реакцию. Она формирует комплексный иммунный ответ на все белки коронавируса, а не только на S-белок или его компоненты.
«Спутник Лайт» — это векторный препарат на основе аденовируса человека, который используется для транспортировки генетической информации коронавируса SARS-CoV-2. Вакцина является первым компонентом «Спутника V» и не требует введения второй дозы.
У «Спутника V» и «Эпиваккороны» интервал между инъекциями составляет три недели, а у «Ковивака» — две недели.
Какие антитела сильнее — после болезни или прививки?
На этот вопрос ответили ученые из США, опубликовавшие в журнале Scientific Reports результаты исследования, посвященного этой теме. Специалисты рассказали, что происходит с антителами после болезни и введения вакцины.
Ученые взяли 41 образец сыворотки у 33 человек с документально подтвержденной историей инфекции SARS-CoV-2. Затем этот материал сравнили с сыворотками 28 человек, у которых никогда не было COVID-19, но которые получили две дозы мРНК-вакцин (Pfizer или Moderna). Результаты группы после иммунизации вакциной также сравнивали с группой вновь диагностированных пациентов с COVID-19.
Выводы довольно показательны:
- Исследование показало, что у привитых людей в 17 раз больше нейтрализующих антител по сравнению с людьми с естественным иммунитетом.
- У привитых в 30 раза больше антител, чем у заболевших.
- Более высокие уровни антител у вакцинированных людей приводят к лучшей нейтрализации патогена.
Данные показали, что антитела, вызванные вакциной против коронавируса, работают лучше, чем те, которые вырабатываются при заболевании. Получается, что у привитых шансы заразиться или тяжело переболеть значительно ниже.
В условиях другого варианта коронавируса антитела из образцов привитых людей оказались также гораздо эффективнее в его нейтрализации, чем антитела, образовавшиеся после заболевания. Соответственно, ученые пришли к выводу, что антитела, индуцированные мРНК, более эффективны против вариантов патогенов, чем «естественный иммунитет».
Справедливости ради стоит отметить, что исследования проводилось в лабораторных условиях и с определенными вакцинами, поэтому нельзя сказать на 100%, что выводы касаются любых прививок. Также ученые отметили разницу в медианном возрасте между группами с естественным иммунитетом и вакцинированными группами, хотя это не должно объяснять столь большую разницу в уровнях антител
Изучение эмбрио-, фетотоксичности и тератогенных эффектов в антенатальном и постнатальном периодах развития
Беременные крысы линии Wistar (N = 60) были случайным образом распределены в три группы и иммунизированы внутримышечно на 2, 9 и 16 дни беременности. Крысам из первой исследуемой группы вводили одну дозу вакцины (6 мкг/доза; 0,5 мл), из второй — двойную дозу (12 мкг/доза; 1,0 мл), а из третьей контрольной группы — двойную дозу плацебо (1,0 мл). Ежедневно проводилось измерение массы тела и общего физического состояния животных; на поздних сроках беременности с помощью теста «открытое поле» оценивалась исследовательская активность и состояние самок. Прибавка в весе у самок проходила нормально; летальных исходов или признаков интоксикации не наблюдалось. Ни в одной из исследуемых групп не было признаков преждевременных или трудных родов. В тесте «открытое поле» на 18-е сутки беременности все самки крыс продемонстрировали преимущественно сбалансированный тип поведения с умеренной двигательной и поисковой активностью без признаков беспокойства.
Половину (N = 10 из каждой группы) животных в каждой группе умерщвляли на 20-й день беременности. Статистически значимых различий между исследуемыми группами по количеству желтых тел в яичниках, местах имплантации в матке, живым и мертвым плодам не было. Плоды сформировались нормально, топография всех исследованных органов была в пределах анатомической нормы, гистологическое строение соответствовало возрасту эмбрионов, развитие костей было нормальным. Патологических изменений органов и тканей обнаружено не было.
Другая половина (N = 10 из каждой группы) животных в каждой из трех групп вакцинированных была использована для выявления возможных нарушений эмбрионального развития, проявляющихся в постнатальном периоде. За потомством наблюдали в течение 60 дней после рождения. Проводилась оценка общего состояния потомства крыс, выживаемость, прибавка в весе, физическое развитие, сформированность сенсомоторных рефлексов, эмоционально-произвольного поведения и способности точно координировать движения. Соотношение самцов и самок в потомстве во всех группах было практически одинаковым (примерно 1: 1). Во всех исследуемых группах за весь период наблюдения (от рождения до двухмесячного возраста) смертность детенышей не превышала 4 % и достоверно не различалась между группами. В группах не было различий в физическом и неврологическом развитии детенышей крыс, а индивидуально обусловленные значения исследуемых показателей находились в пределах физиологической нормы.
Таким образом, вакцина «КовиВак» не оказала отрицательного влияния на общее состояние беременных крыс. Эмбриотоксических, фетотоксических или тератогенных эффектов обнаружено не было. Вакцинация не привела к увеличению смертности потомства и не повлияла на физическое и психологическое развитие детенышей крыс.