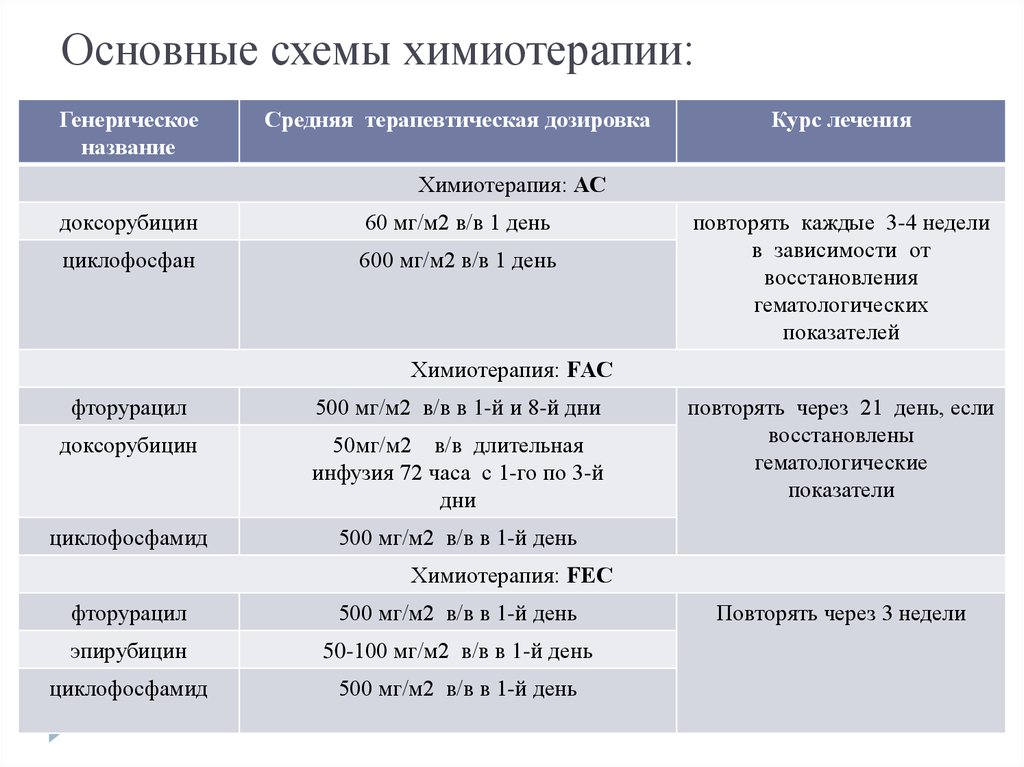
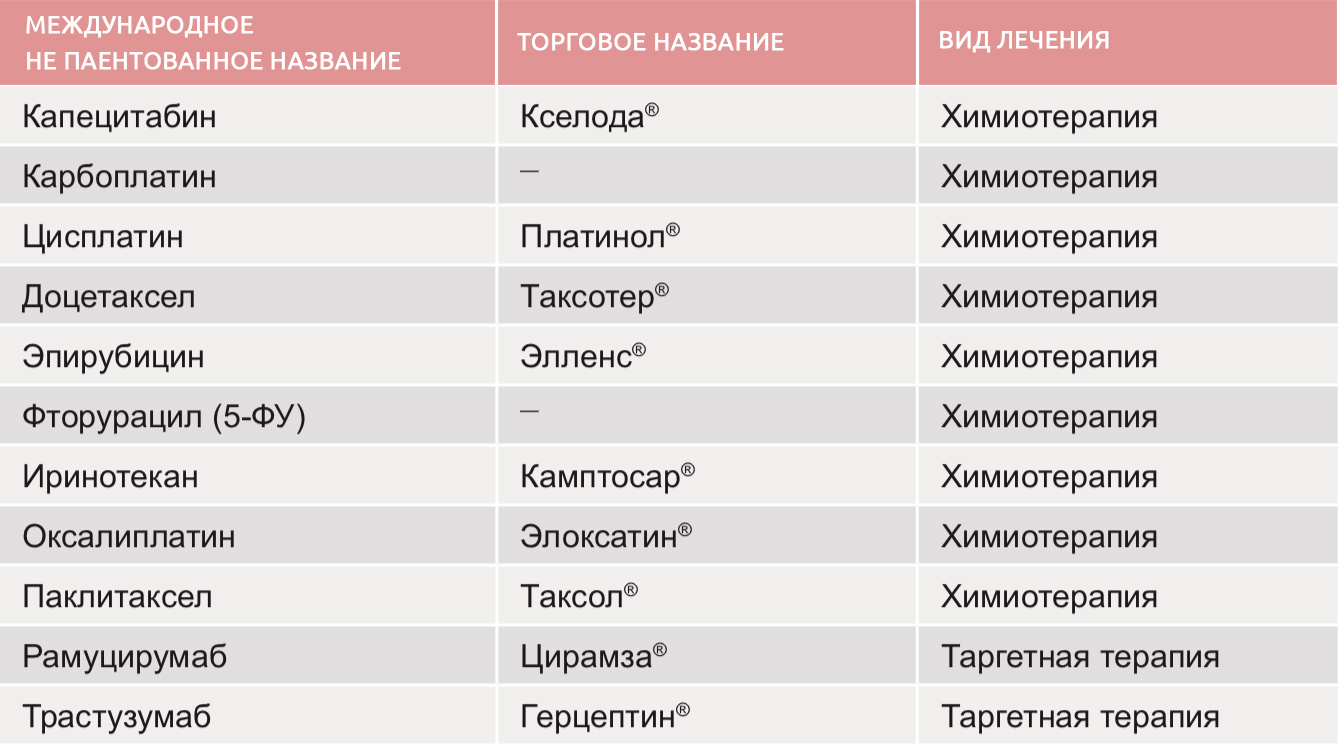
Как должны питаться пациенты, проходящие химиотерапию?
Во время борьбы с раком пациент должен соблюдать сбалансированный рацион питания. Грамотно подобранный рацион позволит укрепить иммунитет, даст организму возможность справиться с тяжелыми последствиями лечения онкологии, восстановить силы и защититься от инфекционных заболеваний. Пациентам, у кого диагностирован рак прямой кишки, в дневной рацион нужно добавить:
- растительное масло – кунжутное, оливковое и прочие;
- морепродукты;
- травяные чаи;
- каши и цельнозерновой хлеб;
- нежирную кисломолочную пищу;
- чеснок;
- нежирное мясо – птицу или кролик;
- фрукты;
- паровые, тушеные, отварные или просто свежие овощи (особенно полезной будет капуста брокколи, поскольку ее добавление в пищу показано именно при этом заболевании).
Больным раком стоит отказаться от сладостей, фастфуда, крепкого чая и кофе, алкогольных напитков, жирного мяса, рыбы и молочных продуктов, кетчупа и майонеза, газированной воды и пакетированного сока, соленых, жаренных, копченых и консервированных блюд.
Побочные действия химиотерапевтических препаратов.
Противоопухолевые препараты предназначены для уничтожения быстро размножающихся клеток. Но кроме раковых клеток в организме есть некоторые здоровые клетки, которые также быстро размножаются. Это клетки:
- Костного мозга;
- Слизистой оболочки пищеварительного тракта;
- Волосяных мешочков;
Побочные действия химиотерапии связаны с повреждением этих нормальных клеток. Некоторые препараты могут негативно влиять на работу сердца, почек, др. органов и нервную систему.
Какие именно побочные эффекты и как ярко они будут выражены, зависит от типа химиотерапии, дозы препарата и состояния здоровья пациента до начала химиотерапевтического лечения.
Лечащий врач ознакомит вас с возможными в вашем конкретном случае побочными действиями до начала химиотерапии и составит план подготовки к лечению.
Время — важный фактор в лечение рака. Поэтому все необходимые специалисты клиники Союз начнут работать с вами в день обращения к онкологу. Они же будут контролировать ваше состояние на протяжение всего курса лечения. Вам не надо тратить время на поиски «узких» специалистов, записываться и ждать приема в других клиниках. Наши специалисты кроме основного профиля – гастроэнтеролог, гигиенист, стоматолог, гинеколог, уролог и т д. хорошо знают специфику онкологии и нюансы лечения химиотерапевтических пациентов.
Одно из неприятных и болезненных побочных действий химиотерапевтических препаратов-склерозирование сосудов. Оно возникает при воздействие лекарства на стенку сосуда малого диаметра, через который осуществляется введение растворов. Чтобы избежать этого осложнения прибегают к установке сосудистого порта. Это конструкция, которую устанавливают в крупную вену — чаще подключичную, и через которую специальной иглой вводится лекарство. При этом лекарство не контактирует со стенками сосуда и не приводит к его склерозированию.Установка порта производится в операционной под местной анестезией в течение 30 минут.
Побочные действия химиотерапии неудобны, но их следует рассматривать как неизбежность, сопутствующую лечению рака.
Важно помнить, что эти лекарства сражаются за вас в большой битве. Химиотерапевтическое лечение является борьбой за вашу жизнь
Если иммунитет «растерялся»
В крови человека есть клетки, выполняющие защитную функцию. Это T и B-лимфоциты. Они помогают расправляться как с инфекционными агентами, так и с аномальными образованиями: обнаруживают, передают информацию о «преступниках», ликвидируют угрозу и сохраняют в памяти сведения о контакте. На оболочках клеток организма находятся рецепторы, которые сигнализируют иммунитету, все ли с ними в порядке. Зараженные вирусами или атипичные образования подлежат уничтожению.
Маркировка опасных раковых клеток
Если иммунная система пропускает начало опухолевого процесса, болезнь прогрессирует. Раковые клетки действуют хитростью, маскируя свои рецепторы специальными белками.
Микробиологи изобрели так называемые моноклональные антитела. Это белковые молекулы, имеющие сродство только к определенным рецепторам. Антитела связываются с раковыми клетками, не только делая их видимыми для иммунной системы, но активируя их уничтожение.
Моноклональные антитела созданы для молекул, отвечающих за развитие разных заболеваний. Этот принцип лег в основу таргетной (прицельной) терапии. Например, препарат Ритуксимаб эффективен при лечении B-клеточных лимфом, Цетуксимаб для борьбы с раком толстой и прямой кишки, опухолями головы и шеи. Бевацизумаб применяют при опухоли молочной железы, толстого кишечника, головного мозга и немелкоклеточном раке легких.
Эти медикаменты доступны и в России. Первое время их производством занимались только иностранные компании. Пациенты с нечувствительностью к стандартной химиотерапии могли опасаться, что препарат не придет вовремя или будет стоить дороже. С 2012 года российская компания Biocad производит биоаналоги: Гертикад, Авегра, Ацеллбия.
Таргетинг эпигенетических регуляторов
Эпигенетическое репрограммирование при раке включает гиперметилирование ДНК, которое часто происходит в промоторных областях островков CpG и, как известно, подавляет супрессоры опухолей.
В большинстве случаев гиперметилирование ДНК при раке можно объяснить повышенной активностью ДНК-метилтрансфераз и потерей активности транслокационных белков (TET, ten-eleven translocation proteins). Транслокационные белки (TET1, TET2 и TET3) деметилируют ДНК и принадлежат к семейству ферментов αКГ-зависимых диоксигеназ.
Используя кислород и αКГ, они катализируют реакции окисления, сначала превращая 5-метилцитозин в 5-гидроксиметилцитозин (Часть 2, рисунок 2). TET2 часто мутирует или соматически утрачивается при миелоидных и лимфоидных злокачественных новообразованиях.
Интересно, что мутации TET2 взаимоисключают мутации, усиливающие активность изоцитратдегидрогеназы 1 (ИЦДГ1) и ИЦДГ2 при миелолейкозе. ИЦДГ1 и ИЦДГ2 превращают изоцитрат в αКГ в цитозоле и митохондриях соответственно.
Но мутация в ИЦДГ1 и/или ИЦДГ2 вызывает изменение ферментативной активности и накопление 2-гидроксиглутарата, который ингибирует функцию αКГ-зависимых ферментов, таких как TET2, что приводит к потере 5-гидроксиметилцитозина, метилированию ДНК и изменению экспрессии генов, которые способствуют развитию рака.
Витамин С как кофактор может активировать транслокационные белки TET. Молекула аскорбиновой кислоты может отдать электрон Fe3+ для синтеза Fe2+, который в свою очередь необходим для активности ТЕТ (Часть 2, рисунок 2). Большая часть мутаций TET2 при остром миелолейкозе — это гетерозиготные мутации, и каждая изоформа TET функционально избыточна. Применение аскорбата может усиливать активность остаточных белков ТЕТ и таким образом предотвращать метилирование ДНК.
Например, ежедневная внутрибрюшинная инъекция высоких доз аскорбиновой кислоты (4г/кг-1) в индуцированной делецией TET2 модели лейкемии на мышах способствовала восстановлению TET2 путем деметилирования ДНК и экспрессии генов, необходимых для дифференцировки миелоидных клеток.
Кроме того, аскорбат in vitro способствовал деметилированию ДНК в генах-усилителях и промоторах генов, связанных с миелоидной дифференцировкой, а также экспрессии нескольких ключевых гемопоэтических генов в клетках мышиного костного мозга, экспрессирующих мутантный ИЦДГ1. При определенных типах лимфом, где TET часто мутируют, лечение аскорбатом in vitro повышает активность TET, приводя к деметилированию ДНК, повышенной экспрессии генов-супрессоров опухоли и повышенной чувствительности к химиотерапевтическим препаратам.
Следует отметить, что во всех исследованиях было исключено влияние окислительного стресса в ответ на высокие дозы аскорбата путем добавления каталазы (которая превращает H2O2 в воду) в культуральную среду, мониторинга изменений клеточных уровней АФК и/или использования 2-фосфат l-аскорбиновой кислоты — стабильного производного витамина С, которое не окисляется в условиях эксперимента.
Также лечение мышей аскорбатом способствовало повышению уровня 5-гидроксиметилцитозина в клетках меланомы и рака мочевого пузыря. Предполагается, что лечение аскорбатом также может быть эффективным при солидном раке с низким уровнем 5-гидроксиметилцитозина.
Еще одно исследование также предполагает, что пероральный прием аскорбата может играть профилактическую роль в развитии лейкоза. Используя несколько различных генно-инженерных моделей мышей, включая мышей Gulo -/-, в организме которых не синтезируется витамин C, и TET2 -/-, было показано, что дефицит аскорбата нарушает регуляцию функции ГСК (гемопоэтические стволовые клетки), что ведет к возникновению лейкоза.
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
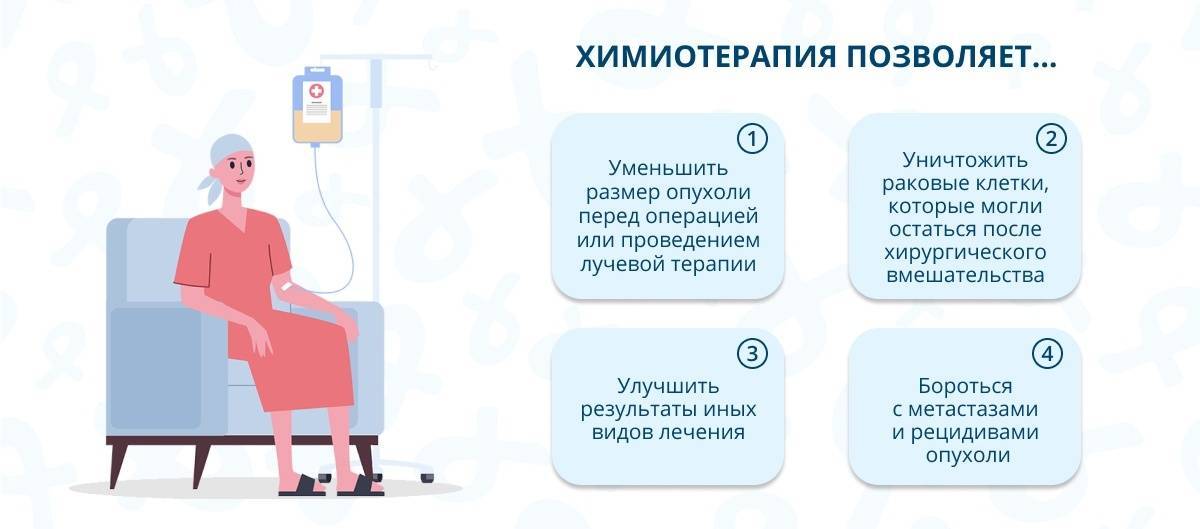
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы
Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
Лучевая терапия в Израиле: возможности и преимущества
В медучреждениях Израиля лучевая терапия уже много лет успешно используется для лечения разных видов онкологических заболеваний. Она позволяет бороться с опухолями разной локализации, выявленными на любой стадии прогрессирования патологии. Кроме того, ее применяют для лечения других недугов: невралгии тройничного нерва, эпилепсии, сосудистых заболеваниях головного мозга и др.
При проведении лучевой терапии используются различные виды радиационного излучения. Цель – разрушить атипичные клетки на молекулярном уровне и при этом не повредить здоровые.
Лечение лучевой терапией в Израиле осуществляется ведущими онкологами и радиологами с использованием современной медицинской техники. Сегодня облучение выполняется с высокой точностью, что позволяет разрушать только клетки патологического очага, не повреждая здоровые. Протокол проведения подбирается индивидуально для каждого пациента, что дает возможность полностью учесть особенности течения заболевания и состояния пациента.
Перед началом курса радиотерапии проводится симуляция, иными словами, первый сеанс терапии, но без облучения. Делается это для того, чтобы определить точное место расположения опухоли, ее размер и форму.
Возможности лучевой терапии
В клиниках Израиля применяется лучевая терапия нескольких видов.
Неоадъювантная. Традиционно предшествует хирургическому вмешательству, ее целью является уменьшение размера опухоли для более легкого ее удаления.
Интраоперационная. Выполняют непосредственно в ходе оперативного вмешательства, чтобы максимально сократить число жизнеспособных атипичных клеток в зоне операции.
Адьювантную терапию проводят после хирургического вмешательства для разрушения оставшихся клеток опухоли и метастазы. Тем самым сокращается риск развития рецидива.
По способу воздействия лучевая терапия бывает контактной и дистанционной.
При контактной терапии, которую еще называют брахитерапией, источник радиоизлучения (в виде катетера, капсулы, зерна и др.) помещают в опухоль или близлежащие ткани. Такое локальное действие позволяет избежать разрушения здоровых тканей.
При дистанционной лучевой терапии используют современные установки – линейные ускорители, которые позволяют воздействовать на опухоль с разных сторон, под разным углом, на различном расстоянии и при этом очень точно.
IMRT (Intensity-modulated Radiation Therapy – радиотерапия модулированной интенсивности) – предоставляет возможность изменять направление и силу излучения во ходе сеанса терапии, при этом не выходя за пределы опухоли.
IGRT (Image Guided Radiation Therapy – радиотерапия под визуальным контролем) используется, когда злокачественные образования находятся в подвижных или меняющих размеры органах (например, в легких, размер которых меняется при дыхании).
RapidArc. Улучшенная технология IMRT. Позволяет проводить облучение опухоли под разными углами (источник излучения вращается вокруг пациента на 360 градусов), при необходимости менять форму и интенсивность пучка.
SBRT (Stereotactic Body Radiation Therapy – стереотаксическая радиохирургия). В некоторых случаях может стать альтернативой хирургическому вмешательству (например, при удалении опухолей в головном или спинном мозге). SBRT проводят с применением очень высоких доз излучения, что позволяет сократить число сеансов.
Современное, сверхточное оборудование и индивидуально подобранный курс (доза излучения, длительность и периодичность сеансов) дают возможность достичь наилучшего воздействия и избежать побочных эффектов.
Один из наиболее широко используемых сегодня ускорителей – Новалис. Но достижением медицинской науки стал аппарат TrueBeam STX, который сочетает в себе все существующие методы радиационного облучения.
Преимущества лучевой терапии
Лучевая терапия в Израиле – это безопасный и эффективный способ борьбы с онкозаболеваниями. Преимущества данного метода лечения:
- успешно используется для разрушения любых злокачественных новообразований;
- воздействует непосредственно на патологический очаг, при этом здоровые ткани не подвергаются облучению;
- отличается безболезненностью, неинвазивностью (или малой инвазивностью, если речь идет о брахитерапии);
- позволяет существенно снизить риск развития рецидива рака;
- может использоваться как самостоятельный метод лечения, так и в сочетании с оперативным вмешательством, химио- и гормонотерапией и др.
Где проводится химиотерапия?
По назначению врача лечение может проходить в условиях дневного или круглосуточного стационара.
Дневной стационар клиники Союз оборудован с учетом специфики химиотерапевтического лечения:
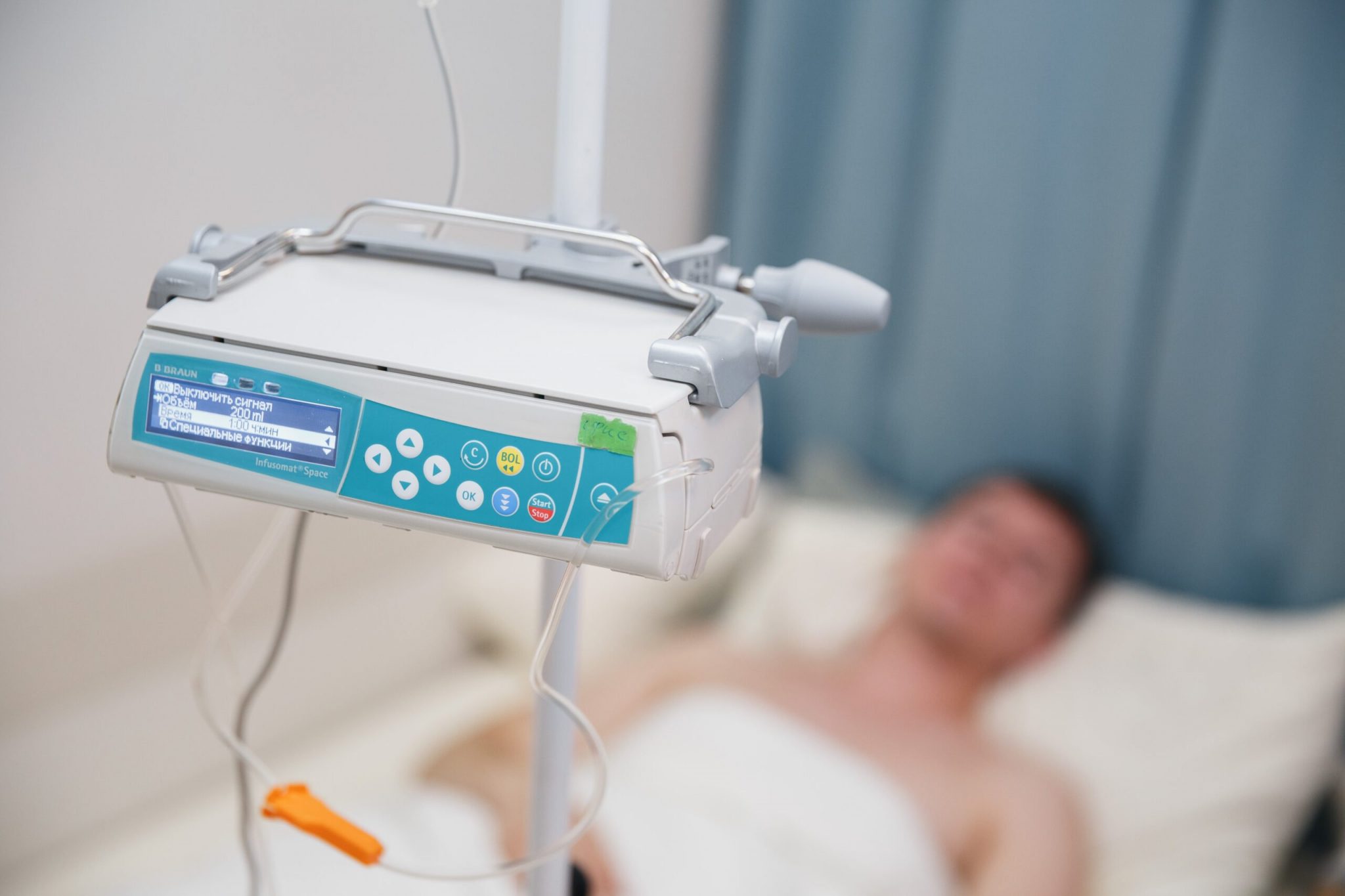
Пациент проводит под капельницей более 4-х часов .Функциональные кровати и кресла обеспечивают удобное положение тела, снимают нагрузку на спину. Прикроватные столики принимают различное положение для удобства работы с ноутбуком, фиксации книги или бумаги для письма. Вы можете удобно расположиться для работы и отдыха.
Введение препаратов должно осуществляться точно отведенное протоколом время.Система должна быть герметична, медперсонал не должен пропустить начало образования тромба. Чтобы исключить человеческий фактор , мы используем аппарат Инфузомат. Прибор точно отмеряет скорость и продолжительность введения лекарства, исключает попадание воздуха в капельницу и венозную систему, сигнализирует об образование тромба и препятствует его продвижению — вам больше не о чем беспокоиться.
В тяжелых случаях, когда к химиотерапевтическому лечению требуется дополнительная подготовка и для работающих пациентов мы проводим лечение в условиях круглосуточного стационара.
Медицинское наблюдение ведет врач-онколог Синявин Д.Ю.- к.м.н.,член, российской, европейской и американской ассоциации онкологов; один из разработчиков европейских рекомендаций по химиотерапии
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи «Евроонко» всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
Запись на консультацию круглосуточно
+7 (495) 151-14-53+7 (861) 238-70-54+7 (812) 604-77-928 800 100 14 98
CAR-T – найти и уничтожить
Генная терапия помогает организму бороться с опухолью посредством модифированных T-лимфоцитов. Их готовят индивидуально. Из крови пациента выделяют нужные клетки, а в структуру ДНК встраивают рецептор, состоящий из нескольких частей. Его внеклеточная часть на оболочке распознает раковые клетки. Внутриклеточная область активизирует другие звенья иммунитета. За счет этого происходит уничтожение опухоли. «Отработавшие» лимфоциты не погибают, а продолжают поиски новых клеток.
Универсальный рецептор на поверхности позволяет настраивать иммунитет против разных опухолевых антигенов. T-клетки легко проникают внутрь раковой опухоли. Так CAR-T позволяет уничтожать самые мелкие метастазы в головном и спинном мозге, снижая риск рецидива. Генную терапию считают более эффективной по сравнению с моноклональными антителами.
Побочные эффекты
У любого курса химиотерапии могут быть побочные эффекты
И когда пациент, с помощью онколога, выбирает вид химиотерапии, ему важно понимать, что, конечно, в процессе лечения все (перечисленные в документации или озвученные врачом) побочные эффекты у него не проявятся. Простой пример: мы все пьем обезболивающие, но нам не приходит в голову проецировать на себя все виды их побочных эффектов
Конечно, какие-то побочные эффекты химиотерапии обязательно проявятся, но далеко не всегда они будут серьезными. Как правило, химиотерапия нормально переносится. Да и если все проходит хорошо, редко кто об этом говорит так же «громко», как о том, что все проходило трудно или с серьезными последствиями для здоровья. Кроме того, проявление очень многих побочных эффектов можно предупредить, а каких-то необратимых состояний, вызванных химиотерапией, очень мало.
Когда применяется консервативная терапия
Ведение онкологических больных проводится по разным протоколам в зависимости от:
- вида рака ;
- степени поражения клеток;
- стадии болезни;
- размера новообразования;
- наличия метастаз — вторичных очагов поражения.
Один из ключевых аспектов лечения — химиотерапия, которая может дополнять хирургическое удаление новообразования или курс облучения, либо служить самостоятельной методикой. На ранних стадиях рака комбинация нескольких методов позволяет повысить шансы на благоприятный исход.
При наличии множественных метастаз на поздних стадиях химиотерапия будет проводиться как поддерживающее лечение для сокращения скорости распространения патологических очагов и продления жизни онкобольного. Благодаря современным разработкам при грамотном подборе медикаментов даже неоперабельные новообразования удается контролировать на протяжении длительного времени.
Основная сложность борьбы с онкологией — несвоевременная диагностика болезни. Метастазы не имеют общей клинической картины. Симптоматика напрямую зависит от места их локализации:
- головной мозг — головная боль, речевые нарушения, тошнота и рвота;
- костная ткань — тянущие или острые боли, частые переломы;
- печень — тяжесть в животе, потеря аппетита, желтуха;
- легкие — одышка, боли за грудиной.
Для точной диагностики места локализации и количества метастаз показано обследование с помощью инструментальных методов — МРТ, КТ , ПЭТ. На основании полученных данных подбирается схема лечения, назначается курс лекарственных средств для подавления роста атипичных клеток.
Когда показана химиотерапия?
Решение о медикаментозном лечении онкологии принимает лечащий врач, основываясь на результатах анализов и аппаратных исследований. Как правило, к химиотерапии прибегают в следующих случаях:
- Тип рака. От разновидности злокачественной опухоли, её размеров и стадии развития зависит выбор оперативного или консервативного лечения. Химиотерапия всегда назначается после хирургического вмешательства для уничтожения оставшихся раковых клеток и возможных метастазов.
- Особенности организма пациента. Если больной раком находится в преклонном возрасте и, скорее всего, не переживёт операцию, либо по другим показаниям (опухоль локализована в недоступном для операции месте, плохое общее состояние, хронические болезни), ему назначают в качестве лечения химиотерапию. В этом случае упор делается на сдерживание роста раковых клеток и увеличение продолжительности жизни человека, больного раком.
Чаще всего медикаментозная терапия онкологии назначается для профилактики метастазирования ранее удалённых опухолей, а также лечения рака крови (лейкоз, гемобластоз) и других редких видов злокачественных новообразований (хориокарцинома, рабдомиосаркома). Также химиотерапия применяется для подготовки опухоли к операции – чтобы хирург мог её полностью удалить, не оставив ни единой раковой клетки.
Как я буду себя чувствовать во время химиотерапии?
ХТ влияет на людей по-разному. Ваше самочувствие будет зависеть от Вашего состояния до ХТ, типа рака, его распространенности, типа ХТ и дозы. Врач не может точно знать, как Вы будете себя чувствовать во время ХТ.
Некоторые не чувствуют себя хорошо сразу же после ХТ. Наиболее частыми побочными эффектами являются усталость, чувство истощения и утомления. Можно подготовиться следующими способами:
- Попросить кого-либо подвезти и отвезти Вас после сеанса ХТ.
- Планировать время остатка дня, когда провели сеанс ХТ и следующего дня.
- Заручиться поддержкой по приготовлению пищи и уходу за детьми в день сеанса ХТ и, минимум, на следующий день.
Как работает традиционное лечение
Стандартные современные методы лечения рака направлены на уничтожение опухоли различными способами:
- оперативное вмешательство;
- введение химиопрепаратов;
- лучевая или радиотерапия
- иммунотерапия
При хирургическом лечении врач удаляет массив атипичных клеток. К недостаткам метода относят невозможность убедиться на месте, что рак удален в полном объеме, и сложность проведения операции в труднодоступных местах.
Во время химиотерапии пациент получает лекарства, которые нарушают жизнедеятельность, тормозят размножение клеток опухоли или стимулируют их апоптоз. Препараты воздействуют и на здоровые ткани организма, что ухудшает переносимость лечения. У ряда пациентов рак может и не реагировать на стандартные средства.
Радиотерапия борьба с опухолью различными видами излучения. Она повреждает ДНК быстро делящихся клеток, приводя к их гибели. Недостаток метода заключается в невозможности прицельного воздействия только на патологический очаг.
Чтобы стандартное лечение помогло пациенту, необходимо стечение обстоятельств:
- небольшой размер и хорошая доступность первичной опухоли,
- низкая злокачественность и хороший ответ на препараты,
- хорошая переносимость курса терапии.
А как же быть тем, чья история борьбы с раком осложнена отягчающими обстоятельствами? В области онкологии новости лечения связаны с преодолением стандартных проблем терапии:
- нечувствительность рака к препаратам или облучению;
- невозможность воздействия только на клетки опухоли;
- большой объем образования и риск непереносимости терапии;
- риск оставить рак на месте после операции.
Имплантируемый порт. Плюсы и минусы
Внутривенную химиотерапию можно делать через порт или через вену (катетер). Если предстоит долгое лечение (больше 6-8 курсов химиотерапии) или используется доксорубициновая, т. н. «красная» химия (при раке молочной железы), порт, который вшивается под кожу, наиболее предпочтителен. Таким образом не портятся (прокалываются) и не лопаются вены. А в случае «красной» химии можно гарантированно избежать случайного попадания химиопрепарата под кожу и развития некроза.
Риски при установке порта:
прокол легкого (небольшая вероятность, последствия не критичны — одышка, кашель);
инфицирование порта (вероятность 1-2% — порт извлекается, назначаются антибиотики, устанавливается новый порт).
Порт устанавливается по рекомендации врача и желанию пациента.
Ограничений по времени ношения порта нет. Если порт не инфицирован, его можно носить несколько лет — например, три года и дольше.
Если порт не используется, при малейшем ощущении дискомфорта во время подачи химиотерапевтического лекарства (жжение, вздутие) необходимо перекрыть капельницу и позвать медперсонал. Именно в таком порядке.
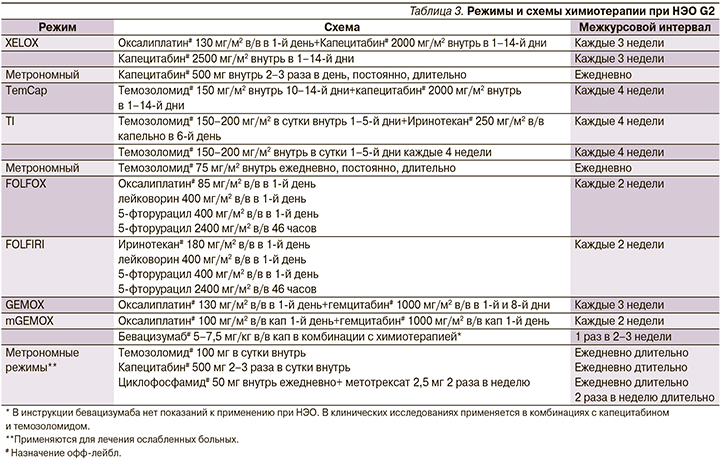
Лечение химическими препаратами в зависимости от стадии
Лечение рака прямой кишки во многом зависит от стадии заболевания:
- Злокачественные новообразования на первой стадии проростают в глубокие стенки, но еще остаются в прямой кишке. Сюда относятся раковые опухоли, которые переродились из доброкачественных полипов. Химиотерапию в данном случае назначают, если в ходе операции врач выявил, что рак распространился сильнее, чем предполагалось. Из медикаментов используется Капецитабин и Фторурацил.
- Опухоли на 2 стадиях прорастают сквозь стенки кишечника, внедряясь в ткани, расположенные поблизости. На данном этапе болезнь еще не распространяется на лимфатические узлы. Большинству больным раком прямой кишки требуется терапия химическими препаратами. После операции назначают дополнительную химиотерапию, длящуюся в сумме полгода. Пациенту может назначаться схема FOLFOX (Оксалиплатин, Фторурацил и Лейковорин), Фторурацил в сочетании только с Лейковорин, CapeOx (назначается Капецитабин в комбинации с Оксалиплатином), или же монотерапия Капецитабином.
- Для рака прямой кишки 3 стадии характерны злокачественные образования, распространившиеся в ближайшие лимфоузлы, но их нет в других частях тела. Химиотерапию назначают после операции, ее продолжительность составляет полгода. Врачи назначают такие же протоколы лечения, что и при вторых стадиях заболевания. Есть альтернативный вариант – изначально пациент принимает только химиотерапические средства, а затем следует химиолучевое лечение.
Вылечить 4 стадию заболевания достаточно сложно, в данном случае злокачественные опухоли распространяются в других отдаленных органах и тканях – печень, легкие и прочие. Методики борьбы с раком прямой кишки могут быть разными, все зависит от сложности патологии. Если рак операбелен и все следы болезни можно устранить при помощи хирургического вмешательства (к примеру, диагностировано только несколько опухолей в легких и печени), то может использоваться:
- Хирургическое вмешательство для удаления новообразования и отдаленных метастазов, после которого назначают химиотерапию. В некоторых случаях может добавляться и лучевое лечение.
- Курс применения химических препаратов с последующей операцией для удаления отдаленных метастазов и самого злокачественного образования. Как правило, после завершения операции дополнительно назначают химиолучевую терапию.
- Использование химиотерапевтических средств, затем химиолучевая терапия и после операция для вырезания опухоли прямой кишки и метастазов. Также после операции могут назначать дополнительную химиотерапию.
- Прием химических средств, лучевое лечение и дальнейшее хирургическое вмешательство. После операции также может назначаться повторный цикл химиотерапевтических веществ.
Вышеперечисленные методы борьбы с раком прямой кишки позволяют повысить выживаемость пациентов, а в некоторых случаях и полностью исцелить недуг. Если обнаруживаются вторичные очаги поражения заболеванием только в печени, то врач назначает химиотерапию, при этом препараты вводят напрямую по артерии, которая ведет к печени – инфузия в печеночной артерии. Во время поступления химиотерапевтических средств прямо через кровоток сразу в печень достигается более выраженный положительный эффект, нежели при пероральном использовании препаратов или внутривенном введении.
Также на четвертых стадиях может диагностироваться неоперабельность опухоли. Если образование более распространено и не подлежит хирургическому удалению, то лечение зависит от отсутствия или наличия кишечной непроходимости. Если она есть, то требуется срочная операция. Если нет, то с раком начинают бороться при помощи химических препаратов, также эффективность проявляет таргетная терапия.
Конъюгаты антитело-лекарственное средство
Конъюгат антитело-лекарственное средство (ADC Antibody-Drug Conjugate) представляет собой моноклональное антитело, связанное с химиотерапевтическим препаратом. Применение конъюгатов антитело-лекарство в качестве эффективных средств нацеливания на опухолевые клетки все еще находится в начальной стадии клинического применения. Этот подход включает и сочетает специфичность антител и активность химически конъюгированных цитотоксических агентов по уничтожению патологических клеток. Антитело в структуре ADC действует как нацеливающий агент и наноразмерный носитель для доставки терапевтической дозы цитотоксического груза в желаемые опухолевые клетки. Он присоединяется к белку HER2 на раковых клетках, доставляя химиотерапевтическое лекарственное вещество непосредственно им.
Адо-трастузумаб эмтанзин (Кадсила, TDM-1): Используется в качестве монотерапии для лечения опухолей молочных желез на ранней стадии после оперативного вмешательства (когда химиотерапия и трастузумаб вводились перед операцией в качестве неоадъювантного лечения). Также используется для терапии метастатического рака у женщин, которые уже получали трастузумаб и химиотерапию. Таким образом его используют для лечения рака, который устойчив к терапии трастузумабом, таксанами. Этот препарат вводится внутривенно, дозировка рассчитывается индивидуально.
Кадсила
Фам-трастузумаб дерукстекан (Энхерту): Назначают в качестве монопрепарата для лечения неоперабельных опухолей и метастатического распространенного рака. Назначается обычно после двух других схем с использованием таргетных препаратов против HER2. Этот препарат вводится внутривенно, дозировка рассчитывается исходя из массы тела и составляет 5,4 мг/кг. Вводится через 21 день, курс определяется индивидуально.
Какие последствия имеет химиотерапия рака прямой кишки?
В борьбе с заболеванием используются сильнодействующие химические препараты с высоким уровнем токсичности, которые могут существенно ухудшить самочувствие больного. Пациенты, проходящие химиотерапию, могут столкнуться со следующими осложнениями:
- Приступы тошноты и рвоты. Для купирования или устранения данных симптомов используются разнообразные антиэметики, к примеру, блокаторы серотонина, Дексаметазон и прочие.
- Диарея. Регидрационная терапия позволяет восполнить дефицит жидкости, для устранения признаков диареи может использоваться Лоперамид или Аттапульгим, снизить болевой синдром помогут анальгетики и спазмолитики.
- Мукозит – специфический воспалительный процесс во рту. Чтобы его устранить используется дезинфицирующий раствор местного действия, ранозаживляющие и обволакивающие препараты совместно с анальгетиками.
- Дерматотоксичность – выражается в форме очагов высыпаний, зуда или гиперпигментации. Могут наблюдаться симптомы ладонно-подошвенного синдрома с отечностью, покраснением, зудом на коже рук и стоп. При данном побочном эффекте необходимо снизить дозы химии или отменить их прием.
- Миелотоксичность. Угнетение кроветворения требует коррекции дозировок цитостатиков.
В любом случае, курсы использования химических препаратов не проходят бесследно, поэтому нужно быть готовым к многочисленным негативным реакциям.