Диагностика АИЗ
Этапы диагностики аутоиммунных болезней:
Клиническая диагностика
На аутоиммунный процесс указывает хроническое течение заболевания, устойчивость к обычному лечению. Некоторые АИЗ имеют общие клинические и лабораторные признаки. Так, системные заболевания соединительной ткани (коллагенозы) обычно дают повышение СОЭ крови, а также увеличение фибриногена, гамма-глобулина, С-реактивного белка. Общими клиническими симптомами может быть длительная лихорадка, слабость, немотивированная утомляемость, потеря веса.
Некоторые АИЗ имеют настолько типичную клиническую картину, что диагноз может быть выставлен:
- на основании осмотра (например,псориатические бляшки, «бабочка» на лице при СКВ);
- опроса (характер болей при ревматоидном артрите, болезни Бехтерева);
- результатов обследований (гипергликемия у детей или молодых лиц указывает на сахарный диабет 1 типа, выявление изменений слизистой кишечника по типу «булыжной мостовой» указывает на болезнь Крона и т.д.)
Иммунологические тесты
Не все АИЗ можно диагностировать на основании клинической картины. Желательно подтверждать их аутоиммунную природу исследованием специфических аутоантител.
Для некоторых заболеваний есть обязательные тесты, которые специфичны только для этих болезней, например:
- РФ (ревматоидный фактор) и АЦЦП (антитела к циклическому цитруллинированному пептиду) при ревматоидном артрите.
- Антитела к рецепторам ТТГ при болезни Грейвса.
- Антитела к ТПО (тиреопероксидазе) при аутоиммунном тиреоидите.
Другие антитела неспецифичны и обнаруживаются при разных АИЗ. Так, АНФ (антинуклеарный фактор), антитела к нативной ДНК, антифосфолипидные антитела выявляются при системной красной волчанке, синдроме Шегрена, склеродермии, антифосфолипидном синдроме. Их обнаружение помогает поставить диагноз только в сочетании с типичными симптомами.
Существует множество других иммунологических тестов, распространенных и не очень, которыми можно подтвердить АИЗ в сомнительных случаях. Не стоит пытаться назначить себе анализ самостоятельно, лучше обратиться к специалисту.
Исследование антигенов HLA
Это антигены гистосовместимости, находятся на поверхности любой клетки, и именно они определяют иммунный ответ. Набор антигенов HLA уникален для каждого человека, и замечено, что некоторые из них в той или иной степени ассоциировано с возникновением определенного АИЗ, поэтому их исследование иногда применяется для дифференциальной диагностики.
Наиболее часто в настоящее время применяется исследование HLA –В27, который в 90% выявляется у пациентов с болезнью Бехтерева и синдромом Рейтера.
Во всем виновата генетика или среда?
Что именно провоцирует АИЗ, до сих пор точно не известно. Исследователи указывают на наследственность и провоцирующие факторы окружающей среды, в том числе стресс, инфекции, травмы, курение, антибиотики и др.
В рамках недавнего исследования сравнивались данные о 116 320 близнецах из шведского регистра близнецов, который ведет Каролинский институт. Было обнаружено, что ряд АИЗ зависят от генов более чем на 85%: это болезнь Аддисона (надпочечниковая недостаточность), целиакия, или непереносимость глютена, и диабет первого типа. А факторы окружающей среды способствуют развитию болезни Базедова (диффузный токсический зоб), кожного заболевания витилиго, аутоиммунного гастрита и тиреоидита Хашимото, связанного с недостаточной активностью щитовидной железы.
Среди близнецов с наследственными АИЗ нередки случаи, когда один заболевает, а другой нет. Профилактикой, как и при всех болезнях, служит здоровый активный образ жизни, правильное питание, избегание вредных факторов окружающей среды, полноценный сон.
Совсем недавно было доказано, что ключевую роль в развитии и созревании нормальной иммунной системы играет микробиом кишечника. Ряд отклонений в составе микробиома связан с развитием многих АИЗ. Летом 2020 года вышло исследование о вреде антибиотиков для микробиома и об их патологическом влиянии на примере двух ключевых АИЗ: воспалительных заболеваний кишечника и диабета первого типа. Если связь микробиома и АИЗ действительно существует, то действенным лечением может стать трансплантация фекальной микробиоты, терапия с помощью пробиотиков и пребиотиков. По этим направлениям ведутся клинические испытания, и уже есть положительные результаты.
Впрочем, бывают случаи, когда антибиотики, наоборот, могут помочь в лечении АИЗ. В 2018 году вышло исследование о вредоносных бактериях, которые обнаруживались в тонком кишечнике мышей и людей и демонстрировали способность перемещаться в другие органы, запуская патологический иммунный ответ. Тогда ученые обнаружили, что аутоиммунную реакцию можно подавить с помощью антибиотика или вакцины, предназначенной для борьбы с этими бактериями. Но все же основная тенденция такова: чем больше антибиотиков использует человечество, тем больше становится больных с АИЗ.
Кратко об иммунитете
Иммунитет – это система защиты нашего организма. Человек живет в мире, населенном бактериями, вирусами, паразитами, простейшими, которые постоянно стремятся внедриться в наше тело. Более того, большинство из них просто не может существовать вне человека. Что было бы, если препятствий для этого не было? Человечество давно было бы уничтожено, потому что на самом деле микроскопический мир намного многочисленнее и сильнее нас.
Да, внутри нас постоянно идет война. И защищает нас мощная армия под названием иммунная система. Она очень сложная, сформировалась в процессе эволюции, постоянно совершенствуется и действительно является надежным защитником. При проникновении в организм чужеродного агента иммунные клетки уничтожают его или прямо, или опосредованно путем выработки антител. Точно также иммунитет борется с чужими тканями (трансплантированными от доноров), а также раковыми опухолями.
Но как в самой совершенной компьютерной системе бывают сбои, так и система иммунитета не всегда идеальна. Точную причину, по которой наша защита дает ошибки, ученые до сих пор не выяснили. Но факт доказан: иногда иммунные клетки ошибочно принимают собственные клетки за чужие и начинают их уничтожать. Так развиваются АИЗ.
Флуоресцентный имиджинг Aldara-индуцированного псориаза у мышей TNF-2A-Kat
Поскольку репортерные мыши позволили выявить «кожный фенотип» в экспрессии TNF у наивных мышей, возник вопрос об уровне экспрессии этого цитокина в условиях экспериментального воспаления кожи, такого как псориаз. При проведении сравнительного флуоресцентного имиджинга Aldara-индуцированного псориаза у мышей TNF-2A-Kat и мышей дикого типа было отмечено, что после серии последовательных нанесений препарата интенсивность сигнала флуоресценции в зоне заболевания у мышей TNF-2A-Kat значительно увеличивалась по сравнению с контрольным сигналом от здорового участка кожи, тогда как при индукции псориаза у мышей дикого типа подобных различий в интенсивности сигнала флуоресценции между участком кожи с псориазом и участком нормальной кожи не наблюдалось.
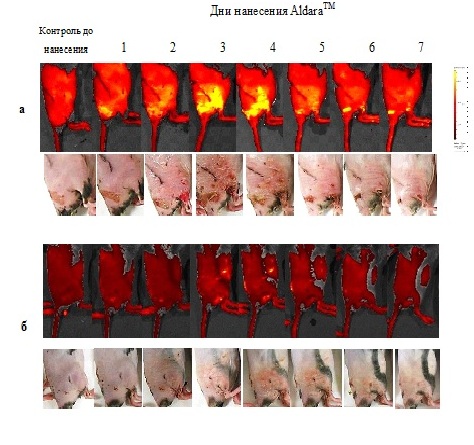
Флуоресцентный имиджинг in vivo и фотографии мыши TNF-2A-Kat (а) и мыши дикого типа (б) в условиях экспериментального псориаза, вызываемого препаратом AldaraТМ.
Наблюдение флуоресценции кожи мышей in vivo в динамике после нанесения псориаз-индуцирующего препарата AldaraТМ показало, что несмотря на формирование псориатических бляшек на коже, изменения сигнала, регистрируемого с поверхности у мышей дикого типа, не наблюдалось. Для мышей TNF-2A-Kat было характерно увеличение сигнала флуоресценции в зоне предполагаемой патологии начиная с 3-го дня после нанесения препарата по 7й день анализа, что, вероятно, свидетельствует о повышенном уровне продукции TNF. С помощью установки для многофотонной томографии MPTflex (Jenlab, Германия) были полученыin vivo изображения участков кожи TNF-2A-Kat репортерных мышей после 7 дней нанесения препарата, а также наивных TNF-2A-Kat репортерных мышей, не подвергавшихся воздействиям AldaraTM. Проводили сканирование кожи по глубине с получением Z-стеков с шагом 5 мкм. Анализ изображений показал, что у TNF-2A-Kat репортерных мышей после нанесения препарата AldaraТМ наблюдается значительное утолщение рогового слоя эпидермиса и избыточное количество кератиноцитов по сравнению с интактным участком кожи, что является признаками псориаза:
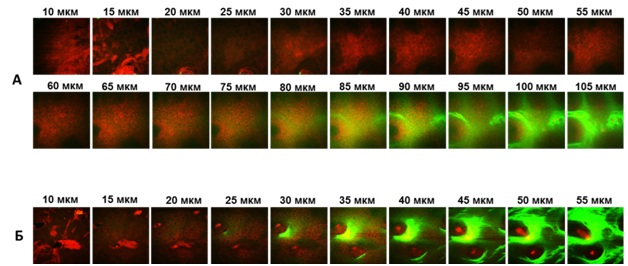
In vivo изображения псориатического участка кожи TNF-2A-Kat репортерной мыши (А) и здорового участка кожи (Б). Глубина слоя указана над изображениями. Красный канал: автофлуоресценция, двухфотонное возбуждение фемтосекундным лазером 750 нм. Зеленый канал: коллаген, генерация второй гармоники. Регистрация флуоресценции в диапазоне 409-660 нм.
Виды, принципы применения и противопоказания к приему ИМ
Науке известны различные классификации иммуномодуляторов. Одна из них связана с их происхождением.
Иммуномодуляторы микробного происхождения
ИМ этой подгруппы включают лизаты бактерий, которые относятся к возбудителям ОРИ (острые респираторные инфекции). Эти лекарственные средства назначают с целью усиления как специфического (вакцинирующего), так и неспецифического (иммуностимулирующего) эффекта. Препараты, попадая внутрь организма, способствуют гибели патогенных микроорганизмов и стимуляции иммунной системы.
Тимические иммуномодуляторы
Их создание стало возможным благодаря открытию пептидных гормонов тимуса. Тимус – это эндокринная железа, которая обеспечивает созревание и иммунологическую «тренировку» клеток иммунной системы. Прием этих ИМ способствует активизации иммунной системы, которая уничтожает вирусы и бактерии, после чего наступает выздоровление.
Цитокины и препараты на их основе
Эта группа ИМ способна регулировать развитие иммунного ответа. Они могут быть основой естественных и рекомбинантных (полученных при помощи современных биотехнологий) иммуномодулирующих лекарственных средств. Препараты способны воздействовать на клетки, которые принимают участие в развитии воспалительных реакций и регенерации – восстановления организма.
Растительные иммуномодуляторы на основе природных средств
Последнее время для стимуляции иммунитета нередко применяются растительные препараты. Например, это производные такого широко известного на сегодня растения, как эхинацея пурпурная. Эта группа ИМ способна повышать неспецифические факторы защиты организма. ИМ применяется при острых инфекционных заболеваниях, которые протекают без осложнений, а также в том случае, если у пациента наблюдается предрасположенность к частым ОРВИ.
Интерфероны
Интерфероны (ИФН) входят в список лекарственных препаратов, которые обладают выраженными иммуномодулирующими свойствами. Интерферон является белковой молекулой, обладающей противовирусным иммунитетом и широким спектром действия (более 300 вирусов ОРВИ). При этом ИФН обладают неспецифической активностью и способны действовать не на конкретных возбудителей болезней, а на все вирусные частицы в целом. Нарушение синтеза интерферона характерно для детей, беременных женщин, ослабленных и пожилых людей.
Среди показаний к использованию иммуномодулирующих лекарств:
- склонность пациента к упорным инфекционно-воспалительным заболеваниям;
- частые рецидивы болезней, их вялое и длительное течение;
- резистентность (сопротивляемость организма) к лечению традиционными лекарственными препаратами;
- заболевания, развивающиеся при воздействии на организм оппортунистических микроорганизмов – условно-патогенных агентов, которых объединяет то, что они возникают только при выраженном снижении иммунитета;
- отсутствие ожидаемого результата лечения при применении этиотропных средств – препаратов, направленных на устранение главной причины развития болезни.
Противопоказания к использованию ИМ
Прием некоторых иммуномодулирующих препаратов может быть не рекомендован при ряде форм бронхиальной астмы, сахарном диабете, гломерулонефрите, токсическом зобе, аутоиммунном гепатите, редко встречающейся эндокринной болезни Аддисона и рассеянном склерозе. В каждом конкретном случае решение о назначении курса лечения с приемом ИМ или без него принимает лечащий врач.
Инсулинозависимый сахарный диабет
Известен также как сахарный диабет 1 -го типа, СД-1 — хроническое аутоиммунное заболевание с инсулиновой недостаточностью, приводящей к нарушению углеводного обмена и других сторон метаболизма.
Болеют лица молодого возраста. У больных происходит активация CD4+TH1 -лимфоцитов и CD8+ цитотоксических Т-лимфоцитов, которые организуют избирательную деструкцию инсулинпродуцирующих бета-клеток в островках Лангерганса поджелудочной железы.
В развитии заболевания имеют значение различные факторы: предрасположенность к данной патологии, связанная с антигенами HLA-B-8, HLA-B-1 5 и др., влияние физико-химических факторов окружающей среды; влияние вирусов и других микробов. Так, вирусы могут способствовать синтезу перекрестно реагирующих антител, активных против бета-клеток железы. На бета-клетках под влиянием ИФН-у Т-лимфоцитов, активированных вирусами, появляются антигены, превращающие бета-клетки в антигенпрезентирующие, организующие иммунитет против своих антигенов. Возрастает активность CD8+ цитотоксических Т-лимфоцитов. Кроме того, ИФН-у активирует NK-клетки и макрофаги против/3-клеток, активированные CD8+ цитотоксические Т-лимфоциты, макрофаги и NK-клетки вызывают деструкцию бета-клеток.
При инсулинозависимом диабете появляются аутоантитела ко многим тканям и органам — бета-клеткам, инсулину, ДНК, щитовидной железе, надпочечнику, желудку; отмечаются артралгия, увеличение слюнных желез, гипергаммаглобулинемия.
Симптомы. Острый период болезни характеризуется полиурией и быстрым похуданием.
Лабораторная диагностика. Предклинический период характеризуется появлением аутоантител к антигенам бета-клеток: глутаматдекарбоксилазе, тирозинфосфатазе-2 (IA-2A), инсулину (IAA) и к цитоплазме островковых клеток ( IС А ). Наиболее четким маркером риска развития сахарного диабета 1 -го типа у детей самого раннего возраста считаются аутоантитела к инсулину.
Лечение. Заместительная инсулинотерапия.
Поиск причин в клетках
Современные исследования АИЗ ведутся на уровне генов, клеток, молекул. И в этой малопонятной для обывателя области есть много успехов. Например, в 2019 году канадским и американским ученым удалось обнаружить, что молекула ALCAM (активированная молекула адгезии клеток лейкоцитов) задерживает развитие рассеянного склероза.
Месяц назад японские исследователи составили первую в своем роде генетическую базу данных по АИЗ. Исследовательская группа из Токийского университета секвенировала полные геномы 79 здоровых добровольцев и 337 пациентов с диагнозом любого из десяти различных АИЗ, включая ревматоидный артрит, системную красную волчанку и рассеянный склероз. На основе сравнения геномов японские ученые просчитали все варианты последовательности ДНК, так или иначе связанные с заболеванием. В итоге исследователи выделили 28 различных типов иммунных клеток, виновных в болезни, и измерили экспрессию генов в этих клетках. Теперь этот «Атлас данных иммунного генома» позволит экспертам глубже понять, как именно развиваются иммунные нарушения, чтобы определить, на какую мишень следует направить лечение.
Например, в отношении болезни Аддисона мишенью может стать ген AIRE. В этом году ученые из Швеции и Норвегии проанализировали 1223 образца от больных пациентов и 4097 образцов от здоровых людей и обнаружили определенные мутации в этом гене. Это исследование генетических причин редкой болезни, связанной с надпочечниковой недостаточностью, — самое крупное в мире на данный момент. И, вероятно, такие «генетические расследования» будут проведены для каждого АИЗ.
Уже лет 50 известно, что с рассеянным склерозом связан вариант гена, называемый HLA-DR15. Но лишь в прошлом году ученые выяснили дополнительный фактор риска: вероятность болезни у носителя этого гена увеличивается в разы, если он инфицирован вирусом Эпштейна — Барра.
Ученые из Тринити-колледжа в Дублине обнаружили, что сбой в работе иммунитета начинается с секреции иммунных клеток IL-17. «Роль IL-17 опосредована — они запускают конвейер по производству других иммунных клеток в лимфоузлах, которые затем поражают нервные клетки спинного и головного мозга», — пояснил один из авторов Кингстон Миллс. Уже существуют препараты, позволяющие блокировать IL-17. Они имеют огромный потенциал и, по мнению Миллса, должны рассматриваться как «прорывное» направление в разработке целого класса новых лекарств. Подобное средство, способное эффективно лечить псориаз, уже прошло стадию лицензирования.
Что же заставляет иммунную систему атаковать собственные ткани? Ответ на этот вопрос ученые ищут внутри самих человеческих клеток. В этом году немецкая исследовательская группа из Мюнхена определила возможную мишень: гиперактивный белок RANK на поверхности В-клеток.
«В-клетки — подгруппа белых кровяных телец (лейкоцитов), вырабатываемых в костном мозге, — играют центральную роль в регуляции иммунных реакций. Во время нормального иммунного ответа активированные В-клетки вырабатывают антитела, которые атакуют чужеродные вещества. Дефектная активация может привести к образованию аутоантител, которые атакуют сам организм, вызывая АИЗ. Активность В-клеток контролируется различными сигналами, некоторые из которых нам еще предстоит понять», — рассказал автор исследования, иммунолог и врач Юрген Руланд, лауреат немецкой научной премии им. Лейбница 2021 года. Руланду и его команде удалось выявить один решающий сигнал, который влияет на активность В-клеток.
В своих опытах они целенаправленно воздействовали на B-клеточные рецепторы мышей. Через несколько недель большая часть грызунов с генетически модифицированными рецепторами заболела системной красной волчанкой, а затем ученым удалось добиться исцеления мышей с помощью терапевтических антител, блокирующих взаимодействие RANK-рецепторов. Этот механизм исцеления, по их мнению, должен сработать и на людях.
Список аутоиммунных болезней
Аутоиммунные заболевания, список наиболее часто встречающихся и основной патогенез их развития:
| Заболевание | Патогенез (очень упрощенно) |
| Рассеянный склероз | Макрофаги уничтожают клетки миелиновой оболочки нервных волокон, нарушается проведение нервных импульсов |
| Сахарный диабет 1 типа | Уничтожение Т-лимфоцитами в-клеток поджелудочной железы, которые вырабатывают инсулин. В результате выработка его резко снижается |
| Болезнь Грейвса (диффузный токсический зоб) | Антитела вырабатываются к рецепторам ТТГ, расположенных на поверхности клеток щитовидной железы. В результате выработка гормонов ЩЖ резко увеличивается |
| Тиреоидит Хашимото (аутоиммунный тиреоидит) | Антитела разрушают фолликулы щитовидной железы. Она воспаляется и не выделяет нужное количество гормонов |
| Ревматоидный артрит | Т-лимфоциты атакуют клетки синовиальной оболочки, развивается воспаление суставов. Медиаторы воспаления могут вызвать системную реакцию в других органах и тканях, иммунные комплексы антиген-антитело повреждают мелкие сосуды |
| Системная красная волчанка (СКВ) | В организме появляются антитела к собственной ДНК. Развивается системное воспаление. Страдает соединительная ткань, почки, сердце |
| Синдром Гудпасчера | Антитела к базальным мембранам легочных альвеол и почечных клубочков. Их разрушение приводит к геморрагическому пневмониту и гломерулонефриту. |
| Синдром Шегрена | Иммунные клетки атакуют железистые клетки и эпителий выводных протоков. Резко сокращается продукция секрета, в первую очередь слезных и слюнных желез. |
| Злокачественная миастения | Образуются антитела к ацетилхолиновым рецепторам нервно-мышечных синапсов. Мышцы теряют способность к нормальным сокращениям. |
| Псориаз | Как одна из причин — скопление лимфоцитов в толще кожи, развитие аутоиммунного воспаления |
| Первичный билиарный цирроз | Лимфоциты начинают разрушать эпителий желчных протоков, отток желчи нарушается, клетки замещаются фиброзной тканью. |
| Аутоиммунная гемолитическая анемия | Иммунная система образует антитела против собственных эритроцитов, в результате они разрушаются. Процесс похож на тот, который происходит при переливании крови другой группы. |
| Идиопатическая тромбоцитопеническая пурпура | Антитела образуются к тромбоцитам, их количество резко снижается |
| Пернициозная анемия | Выработка антител против антианемического фактора Касла, который вырабатывается слизистой желудка. Нарушается всасывание витамина В12 |
| Саркоидоз | В различных органах образуются эпителиоидноклеточные гранулемы, образующиеся в результате воспаления, вероятнее всего аутоиммунного. Поражаются чаще всего легкие, но очаги могут быть в коже, печени, глазах. |
Схема генетических конструкций, кодирующих антитело, связывающееся с TNF и макрофагальным маркером F4/80
| НАЗВАНИЕ | СТРОЕНИЕ | ФУНКЦИЯ |
|---|---|---|
| BV1 | pelB – анти-hTNF VHH – Hinge-region linker – анти-F4/80 VHH#4 – 6хHis | Связывается с макрофагами и блокирует TNF |
| BV1c | pelB – анти-hTNF VHH – Hinge-region linker – анти-HLf1 VHH – 6хHis | Не связывается с макрофагами, но блокирует TNF (отрицательный контроль) |
| BV1mut | pelB – мутантныйанти F4/80 VHH – Hinge-region linker – anti-F4/80 VHH#4 – 6хHis | Не связывается c макрофагами, но блокирует TNF (отрицательный контроль) |
Экспрессию белков проводили в бактериальной системе (E. coli, штамм Rosetta 2(DE3)pLysS). Очистка осуществлялась с помощью жидкостной аффинной хроматографии на колонках с Ni-NTA Agarose смолой. Затем, для переведения в HEPES-буфер, проводили 3 раунда диализа. Присутствие и концентрацию белка в элюате оценивали по изменению оптической плотности раствора при длине волны 280 нм, с помощью спектрофотометра при 320-340 нм в реакции с трихлоруксусной кислотой, а также методом электрофореза в ПААГ. Для обеспечения стабильности препаратов белков BV1, BV1c и BV1mut были использованы различные химические стабилизаторы, которые согласно нормативам Федерального закона «О лекарственных средствах» являются безопасными в производстве и применении терапевтических препаратов. Максимальная стабильность белков наблюдалась при присутствии в растворе 10% D(+)глюкозы или D(+)сорбитола. Кроме того, добавление к раствору белков 50 мM аргинина и 50 мM глутаминовой кислоты увеличивало их растворимость. Для предотвращения образования спонтанных внутри- и межмолекулярных S-S связей в раствор была введена окислительно-восстановительная пара 25mM L-аскорбиновая кислота/20 mcM CuSO4. Для определения эффективности связывания белков с TNF был использован метод ИФА, который основан на «сэндвич» – гибридизации. Максимальная чувствительность полученных препаратов антител составила около 5 нг/мл рекомбинантного TNF, что свидетельствует о высокой эффективности взаимодействия BV1, BV1c и BV1mut с белком-«мишенью».
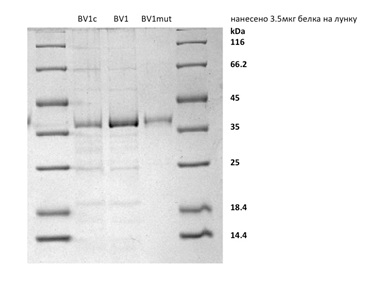
Препараты белков BV1, BV1c и BV1mut после очистки и оптимизации стабильности.
Оценку способности полученными рекомбинантными антителами блокировать TNF проводили с помощью цитотоксического MTT-теста на клетках линии WEHI-164. По результатам теста все три белка обладали ингибирующей активностью по отношению к TNF, и, в концентрации около 100 нМ, полностью блокировали действие TNF, тем самым сохраняя 100% выживаемость клеток.
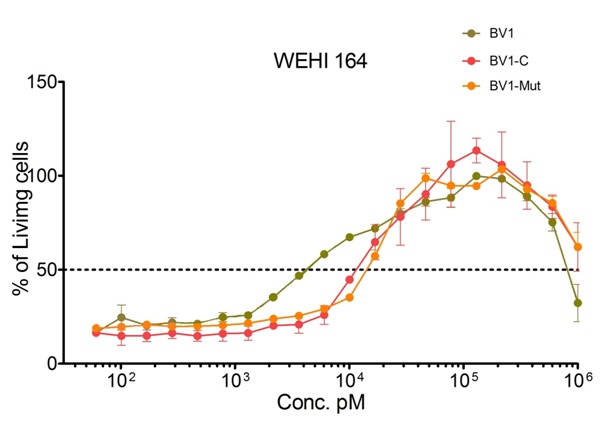
Кривые выживаемости клеток линии WEHI-164 после взаимодействия с TNF в концентрации 200ЕД и белков BV1, BV1-c, BV1-mut в разных концентрациях. Данные обрабатывались в программе GraphPadPrism с помощью метода наименьших квадратов. Показаны 95% доверительные интервалы.
Что такое иммуномодуляторы и в чем их преимущества

В список ИМ препаратов входят лекарственные средства химического и биологического происхождения, которые обладают способностью к угнетению или стимуляции реакций иммунитета. Препараты оказывают влияние на иммунокомпетентные клетки и на их созревание, миграцию и кооперацию.
Стратегия лечения, которая основана на формировании иммунного ответа, обладает рядом преимуществ перед другими видами терапии. Во-первых, иммуномодулирующие препараты не оказывают непосредственного воздействия на патогены и не приводят к развитию лекарственной устойчивости среди отрицательно влияющих на организм микроорганизмов.
Во-вторых, применение иммуномодуляторов дает возможность расширить подход к терапии пациентов, страдающих рядом заболеваний, при которых антибиотики и другие лекарства могут оказаться недостаточно эффективными. В-третьих, ИМ, которые обладают активностью в отношении вирусов, бактерий, грибов и простейших, можно применять в составе неспецифического «неотложного лечения» при появлении новых патогенов, воздействующих на организм.
Как показывает практика, своевременный прием ИМ способен на ранних этапах лечить заболевания, полноценно используя все возможности иммунитета. Это во многих случаях позволяет значительно ускорить выздоровление пациента и минимизировать неблагоприятные последствия болезней.